Кинетика коагуляции. Медленная и быстрая коагуляция
Ход коагуляции в зависимости от концентрации коагулирующего электролита можно подразделить на две стадии (рис. 12): медленную и быструю. При медленной коагуляции изменение концентрации коагулирующего электролита сопровождается резким изменением скорости коагуляции. В области быстрой коагуляции увеличение концентрации коагулирующего электролита не вызывает изменение скорости коагуляции, достигшей своего максимального значения. Концентрацию электролита, начиная с которой скорость коагуляции остается постоянной, называют порогом быстрой коагуляции.
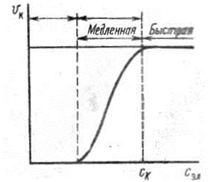
Рис 12 Зависимость скорости коагуляции от концентрации электролита.
Теория быстрой коагуляции была разработана М.Смолуховским. Она основана на предположении, что в области быстрой коагуляции любое столкновение частиц приводит к их слипанию и что все мицеллы золя до коагуляции имеют одинаковый размер и сферическую форму. Число столкновений в единицу времени определяется интенсивностью броуновского движения частиц. Для количественного описания коагуляции М.Смолуховский использовал уравнения формальной химической кинетики. При этом были использованы следующие допущения:
1) при столкновении двух первичных частиц, из которых состоял золь до начала коагуляции, появляются более крупные частицы, называемые вторичными;
2) при столкновении вторичных частиц с первичными появляются третичные частицы;
3) частицы более высокого, четвертого, порядка образуются либо в результате слипания двух вторичных частиц, либо третичной частицы с первичной; подобные процессы приводят к образованию частиц большей кратности.
При увеличении концентрации электролита начинается образование частиц низших (I, II, III и т.п.) порядков, которое протекает незаметно для невооруженного взгляда и называется поэтому скрытой коагуляцией. Дальнейшее увеличение концентрации электролита ведет к прогрессивному развитию коагуляции, повышению её скорости и сопровождается появлением частиц более высоких порядков. Золь претерпевает видимые изменения: он мутнее или изменяется его окраска. Эта стадия процесса называется явной коагуляцией.Переход скрытой в явную называется порогомкоагуляции.
Уравнение скорости быстрой коагуляции можно представить как реакцию второго порядка:
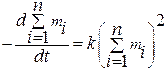 (13)
(13)
где к – константа скорости, m=∑mi=m1+m2+m3+…+mi – общая концентрация частиц всех порядков (кратности) в системе, m1, m2, m3, …, mi – соответственно концентрации первичных, вторичных, третичных, I – ой кратности частиц.
М. Смолуховский развил теорию медленной коагуляции частиц, сохраняющих некоторую стабильность, предполагая, что не каждое столкновение частиц приводит к их слипанию. Кинетика медленной коагуляции развита в работах Н.А.Фукса. Если эффективной является лишь часть столкновений α, то константа скорости реакции равна:
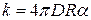 (14)
(14)
При коагуляции вместе с уменьшением числа частиц и их укрупнением происходит изменение ряда свойств растворов: понижается скорость диффузии и фильтрации частиц, увеличивается скорость седиментации, меняется интенсивность рассеянного света, а вместе с тем и окраска растворов.
Вопрос 7. Коллоидная защита, физический смысл явления
Коагуляция в ряде случаев зависит от способа прибавления электролита-коагулятора. Экспериментальные данные свидетельствуют о том, что если электролит добавлять к золю небольшими порциями, то в итоге коагуляция наступает при более высокой концентрации электролита, чем при внесении сразу большого его количества. Такое явление называется привыканием золя.Причиной привыкания золя может быть образование пептизатора или адсорбция ионов, заряженных одноименно с частицей, что приводит к повышению первоначального заряда частицы. Устойчивость лиофобных золей против коагуляции возрастает в присутствии ВМВ: белков, полисахаридов и т.п. Это проявляется в повышении значений порогов коагуляции у защищенного золя и неподчинению правилу Шульце-Гарди.
Механизм защитного действия можно объяснить тем, что макромолекулы ВМВ адсорбируются на поверхности коллоидных частиц, создавая адсорбционные сольватные слои, которые повышают гидрофильность коллоидных частиц. Вследствие этого усиливается взаимодействие частица-растворитель. Сольватные слои обеспечивают большее расклинивающее давление при сближении двух частиц и препятствуют их слипанию. Защитное действие усиливается, если в адсорбционном слое ВМВ образуются гелеобразные структуры, обладающие повышенной прочностью и упругостью (это относится, например к желатину).
В то же время при малых добавках ВМВ в ряде случаев наблюдается не повышение, а снижение устойчивости коллоидов. Это явление называют сенсибилизацией.Объяснить механизм сенсибилизации можно тем, что при малой концентрации ВМВ на частицах образуется рыхлый адсорбционный слой, часть поверхности частиц остается свободной и возрастает вероятность адсорбции одной макромолекулы различными участками на двух частицах дисперсной фазы. Происходит коагуляция путем «сшивания» частиц.
Р.Зигмонди предложил количественное определение защитного действия того или иного защитного коллоида – так называемое золотое число. Известно, коллоидное золото, весьма чувствительное к прибавкам электролита, в высокодисперсном состоянии имеет красный цвет. При уменьшении степени дисперсности золь золота приобретает голубой цвет.
Золотое число выражается количеством миллиграммов защитного коллоида, которое достаточно, чтобы предотвратить изменение цвета 10 мл красного золя золота в голубой при прибавлении 1 мл 10%-ого раствора хлорида натрия.
Чем меньше золотое число, тем больше защитное действие коллоида. Различные защитные коллоиды обладают отличающимся действием и, следовательно, характеризуются различным золотым числом.
Было определено также защитное действие в отношении золей серебра (серебряное число), конго рубинового (рубиновое число), серы и т.д.
На рис. 13 схематично изображен процесс осаждения золя золота под действием электролита и защитное коллоидное действие желатина на золь. Частица золя золота в результате адсорбции анионов приобретает заряд. В отсутствие защитного коллоида эта частица не обладает защитной оболочкой из молекул растворителя и поэтому при добавлении в раствор хлорида натрия легко осаждается. Ионы натрия нейтрализуют заряд золя, частицы золя уже не отталкивают друг друга и агрегируют.
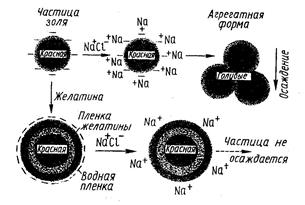
Рис 13 Защитное действие желатина на золь золота.
Если к золю добавить желатин, белок прикрепляется к частицам золя и образует вокруг них защитную пленку. Ионная поверхность желатина сообщает частицам дополнительный заряд, как положительный, так и отрицательный. Поверхность белка адсорбирует молекулы воды, что обеспечивает частицам золя золота добавочную защиту. Добавление хлорида натрия уменьшает заряд золя, но не столь эффективно, как это наблюдалось в отсутствии защитного коллоида. В результате частица не осаждается.
Вопрос 8. Приложение понятия коагуляции к биосистемам
Процессы коагуляции и пептизации имеют большое значение для жизнедеятельности организмов, так как коллоиды клеток и биологических жидкостей также подвержены коагуляции и постоянно испытывают воздействие со стороны электролитов. Согласно правилу Шульце-Гарди для сохранения постоянства физико-химических условий в организме и при экспериментах in vitro необходимо соблюдать постоянство не только концентрации электролитов, но и их качественного состава. Действительно, если приготовить изотонический раствор не из NaCL, а из равной концентрации многозарядных ионов, хотя бы Mg(OH)2, то двухзарядные ионы будут обладать значительно более сильным коагулирующим действием на коллоиды, чем NaCL.
Значение коллоидной защиты для биологии и фармации чрезвычайно велико. Принцип коллоидной защиты используют при получении колларгола, золей серебра, золота и т.д. Частицы колларгола так хорошо защищены, что не коагулируют даже при высушивании. Белки крови защищают капельки жира, холестерин и другие гидрофобные вещества от коагуляции. Ослабление защитных функций белков крови приводит к отложению холестерина на стенках сосудов, образованию камней в почках, печени и т.п
| <== предыдущая лекция | | | следующая лекция ==> |
| Строение коллоидных частиц и правила их записи | | | Понятие о полимерах: классификация и способы получения. |
Дата добавления: 2016-11-04; просмотров: 11453;











