Типы реакций органических соединений
Органические соединения склонны к реакциям различных типов в зависимости от природы и строения органической молекулы, природы действующего реагента и условий проведения процесса (температура, катализаторы и т. п.).
Согласно электронным представлениям, сущность химической реакции заключается в перераспределении электронов между реагирующими атомами. При этом перераспределение электронов в процессе самой реакции бывает по возможности малым.
В начальном акте химического процесса возможны два случая: а) реакция протекает с переносом электронов, б) реакция протекает путем разрыва связи (электронной пары) с образованием новых ковалентных связей.
Реакции первого типа приводят к образованию ионных соединений. К ним относятся такие хорошо известные процессы, как образование хлорида натрия из элементов и др. В этой реакции электроны атомов натрия переходят к атомам хлора. Реакции этого типа протекают с очень большой скоростью — почти мгновенно.
Для органических соединений большее значение имеют реакции второго типа. При этом существующая ковалентная связь может разрываться двумя разными способами:
х:у → : х- + у+
х:у → 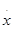 +
+ 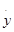
Процесс первого рода называется гетеролитическим (образование разноименно заряженных частиц), а процесс второго рода — гомолитическим. В этом случае образуются свободные радикалы, не несущие электрических зарядов.
Гетеролитические ракции протекают только в жидкой фазе в присутствии полярных растворителей с большой диэлектрической постоянной.
Гомолитические реакции протекают главным образом в газовой фазе или в жидкой фазе, в неполярных или малополярных растворителях.
Гемолитический процесс распада ковалентных связей (образование радикалов или свободных атомов) происходит при фотохимическом разложении, термическом разложении и при разложении в результате переноса электрона.
В качестве примера фотохимического распада можно привести разложение йодистого метила при освещении:
CH3:J→CH˙3+J˙
Образуются радикал метил и атомарный йод, которые затем принимают участие в дальнейших процессах.
Примером термического распада может служить разложение тетраэтилсвинца (этиловой жидкости) в двигателях внутреннего сгорания:
Рb(С2Н5)4 →Рb-4С2Н5˙
Образуются металлический свинец и свободные этильные радикалы.
Примером переноса электрона с образованием свободного радикала является реакция взаимодействия галогенопроизводных углеводородов с металлами
Na˙ + CH3:Cl →Na+Cl-+CH3˙
Образующиеся в этих процессах свободные радикалы очень активны и сразу взаимодействуют с другими радикалами или молекулами. В последнем случае разрушаются существующие химические связи и возникают новые. Иногда такие реакции носят цепной характер.
В качестве примера цепной реакции можно привести изобарный процесс взаимодействия хлора с водородом. В темноте или на слабом свету реакция не идет. При ярком освещении начальным актом является гомолитический распад молекулы хлора на два атома:
С1:С1 → 2С1˙
Атом хлора воздействует на молекулу водорода, вызывая ее распад:
Н2+Сl → НСl + Н˙
В результате процесса образуется весьма активный атомарный водород, способный расщеплять молекулу хлора:
Cl : Cl + H ˙ → НCl + Cl˙ и т. д.
Эта реакция протекает с огромной скоростью и заканчивается взрывом.
Подобным образом протекает действие хлора на метан. В темноте реакция не идет, а при освещении газы начинают легко взаимодействовать:
С12 → 2С1˙
С1 + СH4 → НС1 + СН3˙
Образующийся радикал метил будет реагировать с молекулами хлора, регенерируя атомы хлора, а в присутствии третьих веществ будет реагировать с ними, давая новые активные радикалы. Например:
СН3+СС14 → СН3 Cl + CCl3˙
Введение в сферу реакции небольших количеств веществ — генераторов свободных радикалов — может предотвращать взрывные процессы. Так, в двигателях внутреннего сгорания можно предотвратить развитие детонационного процесса («стук») добавлением к бензину небольших количеств тетраэтилсвинца (этиловой жидкости), который при термическом воздействии разлагается с образованием свободных этильных радикалов. Последние, реагируя с радикалами, образовавшимися при горении топлива, тормозят цепную реакцию и не дают развиваться детонационному процессу.
Гетеролитические реакции можно разделить на два типа.
Первым типом являются реакции, содержащие неподеленный электронный дублет, который будет стремиться связаться с бедной электронами органической частью реагирующей молекулы (нуклеофильный реагент):
у: + R | : х → R : у + х
Вторым типом являются реакции, где реагент беден электронами, потому он будет реагировать с органическими молекулами, богатыми электронами (электрофильный реагент):
у + R: | х → R : у + х
Примером реакции первого типа могут служить реакции гидролиза (омыления) галогенопроизводных, которые приводят к образованию соответствующих спиртов и ионов галогенидов:
НО :-+СН3: J → СН3ОН+J:-
Реакции второго типа протекают преимущественно в ароматических соединениях:
NO2+ + C6H6 → C6H5NO2 + H+
Рассмотренные процессы относятся к органическим соединениям, не содержащим кратных связей. Ненасыщенные соединения склонны к разнообразным реакциям присоединения. Так, они легко присоединяют галогены, галогеноводороды и многие другие химически активные вещества.
При этом электронное облако легко деформируется, смещаясь в сторону одного из атомов углерода, связанных двойной связью, что приводит к образованию полярной молекулы.
Если при этом электроны полностью переходят к одному из атомов, то образуется биполярный ион.
Под влиянием реагирующих веществ возможен и другой тип разрыва связи, при котором каждый из двух атомов углерода, связанный двойной связью, будет содержать по одному свободному электрону , т. е. образуется бирадикал
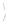 С = С
С = С  →
→ 
В соответствии с этим и протекают различные реакции присоединения к кратным связям.
Так, при действии галогенов происходит смещение электронов к одному из атомов углерода (поляризация):
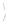 С = С
С = С  →
→ 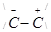
Одновременно в молекуле галогена также происходит смещение электронов, в результате чего один из этих атомов будет обладать только шестью электронами (секстет), а второй — восемью (октет).
Галоген с электронным секстетом более активен и свяжется с тем атомом углерода, который несет избыточный электронный заряд:
 →
→ 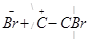
Это приводит к одновременному образованию иона брома, который затем присоединяется к атому углерода:
 →
→ 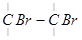
Отсюда вытекает известное правило присоединения к двойной связи полярных соединений, согласно которому галогеноводороды присоединяются к углеводородам с двойной связью таким образом, что водород присоединяется к углероду, содержащему большее число водорода — наиболее гидрогенизированному (правило Марковникова):
СН3-СН = СН2+НВr →СН3—СНВг—СН3 или
+ - + -
СН3 –СН- СН2 + НВr → СНз-СНВr-СНз
При освещении молекула галогена присоединяется к кратной связи по радикальному механизму
Вr + СН3-СН = СН2 → СН3-СН-СН2Вr
СН3-СН-СН2Вr + НВr → СН3-СН2-СН2Вr+Вr и т. д.
К данному примеру правило Марковникова неприменимо, так как полярность в этом случае значения не имеет.
Обратный процесс - отщепление галогеноводородов или элементов воды (реакция элиминирования) - протекает так, что атом водорода из двух возможных положений отщепляется от наиболее бедного водородом атома - наименее гидрогенизированного углерода (правило Зайцева):
СН3-СНОН-СН2-СН3 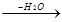 СН3-СН=СН-СН3
СН3-СН=СН-СН3
СН3-СНВr-СН2-СН3 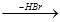 СН3-СН=СН-СН3
СН3-СН=СН-СН3
Дата добавления: 2016-12-09; просмотров: 1893;











