Структурные механизмы упругости и высокоэластичности.
Любой наблюдаемой на макроуровне деформации обязательно должно соответствовать некоторое изменение внутренней структуры деформируемого материала. Более того, характер деформации на макроуровне (то есть функциональные механические свойства) будет определяться характером и механизмом деформации внутренней структуры материала. Для того чтобы понять закономерности упругих и прочностных свойств материалов, необходимо понять, какова их внутренняя структура и что именно происходит с ней при деформации. Прежде всего, следует разделить все материалы на кристаллические и аморфные, то есть по признаку фазового состояния. Фаза, со структурной точки зрения, это область, в которой имеет место совершенно определенный порядок (или отсутствие порядка) в расположении составляющих ее частиц. Если такого порядка нет, то это аморфная фаза. Если же он есть, то мы имеем дело с великим множеством кристаллических фаз и мезофаз, которые отличаются друг от друга наличием трансляционного и (или) ориентационного дальнего порядка и особенностями этого порядка (типом и параметрами кристаллической решетки). При силовом механическом воздействии на твердое тело, очевидно, происходит некоторое смещение структурных элементов, остается понять, как, почему и насколько сильно они этому сопротивляются. Когда происходит подобное смещение, может иметь место перестройка кристаллической структуры (формирование другой кристаллической фазы – с более плотной или же более рыхлой упаковкой структурных элементов), при условии, что такая фаза вообще может существовать. Это определяется природой структурных элементов, составляющих фазу, и характером связей между ними. И конечно, самой структурой фазы – то есть порядком расположения структурных элементов (каковы возможности изменения этой структуры в ту или другую сторону). В роли структурных элементов могут выступать: атомы, ионы, молекулы, фрагменты больших молекул. В принципе, это могут быть и большие надмолекулярные образования, например частицы латекса. Соответственно, целостность всей структуры при этом может поддерживаться разными видами связей: ковалентными (полярными и неполярными), ионными, металлическими и различными межмолекулярными (в том числе и топологическими). При рассмотрении по группам материалов мы увидим, что металлы и натуральные петроиды – это кристаллические материалы, синтетические петроиды – чаще всего аморфные. Полимеры, как известно, в чистом виде кристаллическими не бывают, они либо аморфные, либо аморфно-кристаллические. Натуральные полимеры обычно характеризуются высокой степенью кристалличности. Синтетические полимеры могут быть от полностью аморфных до высоко кристалличных, однако даже полиэтилен – чемпион по кристалличности (его невозможно получить в полностью аморфном состоянии), никогда не бывает на 100% кристаллическим. Тем не менее, каким бы ни был материал, аморфным или кристаллическим, его целостность поддерживается связями между элементами. Для большинства металлов характерна металлическая связь, для петроидов – ионная. Ковалентные связи характерны для органических полимеров и некоторых петроидов (графит, алмаз). Наиболее простую структуру имеют атомные кристаллы, подобные алмазу. В узлах кристаллической решетки находятся атомы, каждый из них связан со своими соседями ковалентными связями. В случае алмаза это равноценные связи. Энергетика взаимодействия между атомами описывается потенциалом Леннарда-Джонса. Единственный вид движения, который могут совершать элементы такой структуры (атомы) это колебания относительно положения равновесия. Разрушение атомного кристалла равносильно разрушению ковалентных связей. Для атомного кристалла несложно рассчитать теоретический модуль упругости и предел прочности на разрыв. Для этого нужно знать энергию связи (для алмаза – С-С связи), ее длину, упругость при растяжении и число связей на единицу площади. Если принять длину связи равной 0,154 нм, энергию 332 кДж/моль, упругость 520 Н/м (силовая константа, связывающая потенциальную энергию молекулы с растяжением, определяется из спектральных данных) и число связей 1.82х1015 шт/см2, то получим величину предела прочности 110 ГПа. На практике для алмаза наблюдается величина предела текучести 54 ГПа. Это несовпадение, как минимум, может быть связано с неидеальностью кристаллов, наличием дефектов. Вообще, расчет теоретической прочности различных материалов может давать ошибку и на несколько порядков, в зависимости от выбранной модели. Простейший расчет предполагает, что работа разрушения равна поверхностной энергии двух новых поверхностей, простейшая формула такова 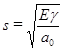 , где E – модуль Юнга, γ – поверхностная энергия, a0 – межатомное расстояние. Таким образом, прочные материалы надо искать среди жестких материалов, имеющих большое число атомов в единице объема. Ионные кристаллы принципиально не отличаются, но для расчета необходимо учитывать кулоновские взаимодействия ионов, находящихся в узлах решетки. Основное отличие состоит в том, что кулоновское притяжение разноименных зарядов малоизбирательно и, в результате, один катион притягивает все соседние анионы. То есть каждый ион координируется с возможно большим числом соседей. Причем большие ионы могут удерживать большее число соседей, чем маленькие (потому что соседи имеют одинаковый заряд и отталкиваются друг от друга). Заметим, что в случае ковалентной связи прочная связь есть только между теми атомами, которые делят электронную пару. Металлическая связь может рассматриваться как нечто среднее между ковалентной и ионной. В металлах атомы расположены в узлах решетки, а валентные электроны практически свободно перемещаются в пределах образца. Таким образом, его целостность поддерживается, с одной стороны, обобществленными электронами как при ковалентной связи, а с другой стороны, фиксированные в узлах решетки катионы удерживаются вместе распределенным отрицательным зарядом. Итак, три типа связей обеспечивают целостность атомных, ионных и металлических кристаллов. В аморфных телах, естественно, действуют те же типы связей, вся разница обусловлена фазовым состоянием и наличием (отсутствием) порядка. Материалы, структурно построенные из атомов или атомарных ионов, обладают высокой прочностью, поскольку их целостность обеспечивается прочными химическими связями, упругость таких материалов также обусловлена свойствами связей. Например, С-С связь в алмазе упруго деформируется до 20% удлинения, при удлинении 21% происходит разрыв связей. Молекулы представляют собой устойчивые структурные единицы. Молекулярные кристаллы характерны для большинства органических соединений, для многих неорганических – вода, аммиак, сернистый ангидрид. Молекулярные твердые тела очень распространены. Целостность структуры молекулярного кристалла поддерживается межмолекулярными связями. Это Ван-дер-Вальсовские взаимодействия, дисперсионные взаимодействия. Неселективные межмолекулярные взаимодействия довольно слабы, поэтому молекулярные твердые тела не отличаются ни жесткостью, ни прочностью. Из наиболее сильных межмолекулярных взаимодействий надо отметить водородную связь. Ее энергия приближается к энергии обычных химических связей. Однако, как известно, практически никогда не используются в качестве конструкционных, единственным исключением является лед. На примере молекулярных материалов сразу же четко видно, что должна быть сильная зависимость прочностных и деформационных свойств от температуры. Как только энергия теплового движения структурных единиц становится больше энергии связей, удерживающих эти структурные единицы, структура рушится без приложения внешних сил, либо внешние силы должны совершить ту работу, которой не хватает до разрушения.
, где E – модуль Юнга, γ – поверхностная энергия, a0 – межатомное расстояние. Таким образом, прочные материалы надо искать среди жестких материалов, имеющих большое число атомов в единице объема. Ионные кристаллы принципиально не отличаются, но для расчета необходимо учитывать кулоновские взаимодействия ионов, находящихся в узлах решетки. Основное отличие состоит в том, что кулоновское притяжение разноименных зарядов малоизбирательно и, в результате, один катион притягивает все соседние анионы. То есть каждый ион координируется с возможно большим числом соседей. Причем большие ионы могут удерживать большее число соседей, чем маленькие (потому что соседи имеют одинаковый заряд и отталкиваются друг от друга). Заметим, что в случае ковалентной связи прочная связь есть только между теми атомами, которые делят электронную пару. Металлическая связь может рассматриваться как нечто среднее между ковалентной и ионной. В металлах атомы расположены в узлах решетки, а валентные электроны практически свободно перемещаются в пределах образца. Таким образом, его целостность поддерживается, с одной стороны, обобществленными электронами как при ковалентной связи, а с другой стороны, фиксированные в узлах решетки катионы удерживаются вместе распределенным отрицательным зарядом. Итак, три типа связей обеспечивают целостность атомных, ионных и металлических кристаллов. В аморфных телах, естественно, действуют те же типы связей, вся разница обусловлена фазовым состоянием и наличием (отсутствием) порядка. Материалы, структурно построенные из атомов или атомарных ионов, обладают высокой прочностью, поскольку их целостность обеспечивается прочными химическими связями, упругость таких материалов также обусловлена свойствами связей. Например, С-С связь в алмазе упруго деформируется до 20% удлинения, при удлинении 21% происходит разрыв связей. Молекулы представляют собой устойчивые структурные единицы. Молекулярные кристаллы характерны для большинства органических соединений, для многих неорганических – вода, аммиак, сернистый ангидрид. Молекулярные твердые тела очень распространены. Целостность структуры молекулярного кристалла поддерживается межмолекулярными связями. Это Ван-дер-Вальсовские взаимодействия, дисперсионные взаимодействия. Неселективные межмолекулярные взаимодействия довольно слабы, поэтому молекулярные твердые тела не отличаются ни жесткостью, ни прочностью. Из наиболее сильных межмолекулярных взаимодействий надо отметить водородную связь. Ее энергия приближается к энергии обычных химических связей. Однако, как известно, практически никогда не используются в качестве конструкционных, единственным исключением является лед. На примере молекулярных материалов сразу же четко видно, что должна быть сильная зависимость прочностных и деформационных свойств от температуры. Как только энергия теплового движения структурных единиц становится больше энергии связей, удерживающих эти структурные единицы, структура рушится без приложения внешних сил, либо внешние силы должны совершить ту работу, которой не хватает до разрушения.
Дата добавления: 2016-12-09; просмотров: 1639;











