Расчет состава жидкой и паровой фаз по законам Рауля и Дальтона.
Обозначим мольную долю первого компонента в жидкой фазе N1, второго компонента N2, и в парах N’1, N’2.
Объединяя законы Рауля и Дальтона, найдем значения мольных долей компонентов в жидкой фазе.
Р = Р1 + Р2 (закон Дальтона)
Подставим выражение для закона Рауля в данное уравнение:
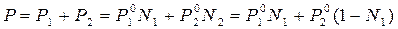


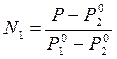 ; если N2 = 1 – N1, то
; если N2 = 1 – N1, то
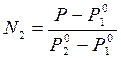
 |
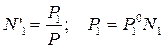
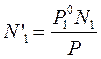
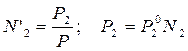
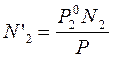
Таким образом, выразили составы жидкой и паровой фаз. Найдем их соотношение для каждого вещества:
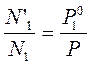 ;
; 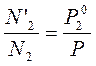
Отношение давления насыщенного пара чистого компонента к общему давлению является величиной постоянной для данного компонента и обозначается через К.
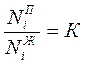 ; (для Т=const);
; (для Т=const); 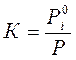
К – это константа фазового равновесия, является очень важной величиной, характеризующей поведение жидких компонентов при перегонке бинарных систем.
Для более летучих жидкостей К>1, тогда NП > NЖ
Для менее летучих жидкостей К<1, и NП < NЖ.
Чем больше разница К1 и К2 двух смешивающихся жидкостей, тем больше кривизна кривой равновесия, выражающей отношение состава пара и жидкости, тем лучше идет разделение при перегонке и ректификации и требуется меньшее количество стадий процесса.
Системы жидкость – жидкость с ограниченной взаимной растворимостью – из теоретической части к лабораторной работе с фенолом и водой, можно рассматривать на примере этой системы.
Дата добавления: 2016-12-09; просмотров: 2069;











