ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
I. Белки, или протеины, – высокомолекулярные органические соединения со строго определенным элементарным составом, распадающиеся при гидролизе до аминокислот. Живая клетка на 50% состоит из белков.
Белки являются теми инструментами, по средствам которых реализуется генетическая информация. В организме белки выполняют следующие функции:
1. Каталитическая (ферментативная) – без неё не протекает ни одна биохимическая реакция в живой клетке.
2. Регуляторная – обеспечение регуляции и интеграция клеточного обмена веществ. Например, инсулин регулирует углеводный, белковый, жировой обмен.
3. Транспортная – связывание и транспорт веществ между тканями и через мембраны. Например, гемоглобин – белок, связывающий кислород воздуха и доставляющий его к различным тканям.
4. Сократительная – обеспечивающая преобразование свободной химической энергии в механическую работу. Сюда относятся белки мышечной ткани миозин и актин.
5. Структурная – белки участвующие в построении различных мембран (плазматических, митохондриальных). Сюда относятся также белки, обеспечивающие прочность опорных тканей: коллаген – структурный элемент опорного каркаса костной ткани, хрящей, сухожилий; кератин – основа шерсти, волос, копыт, рогов и т.д.
6. Защитная – эту функцию выполняют иммуноглобулины (антитела), они обладают способностью обезвреживать бактерии, вирусы, чужеродные белки, попавшие в организм из вне. Например, лизоцимы, интерфероны и др.
7. Резервная – использование белков как запасных материалов для питания развивающихся клеток. Например, проламины, глютелины – белки хлебных культур, альбумин – яичный белок и т.д.
Белки отличаются друг от друга тем, что каждый из них имеет свою определенную аминокислотную последовательность.
Элементарный состав белков следующий, %:
| Углерод – 50,0-55,0 | Кальций – 0,3-0,5 |
| Азот – 15,5-18,5 | Сера – до 1 |
| Кислород – 21,0-23,0 | Фосфор – 0,5-1,5 |
| Водород – 6,5-7,5 | Железо и марганец – в микро количествах |
Кислород, водород, азот и углерод составляют структуру белка и входят в него в большом количестве благодаря тому, что эти элементы обладают следующими свойствами:
- Образуют прочные ковалентные связи;
- Они легкие (имеют маленькую молекулярную массу);
- Углерод, азот и кислород образуют и одинарные и двойные связи, благодаря чему они обуславливают разнообразие свойств белка;
- Углерод способен образовывать прочные четырехмерные каркасы.
Содержание белка в различных продуктах неодинаково, %:
| Мясо, рыба – до 20 | Творог – 12-17 |
| Яйцо – до 12 | Мучные изделия – 3-8 |
| Овощи и фрукты – до 0,5-1,7 | Зернобобовые растения – 22-23 |
Белки животного происхождения являются полноценными. Они содержат все или почти все незаменимые аминокислоты.
Около 25-30% всей потребности организма человека в белках покрывается за счет продуктов переработки зерна.
II. Белки являются высокомолекулярными соединениями. Молекулярная масса их колеблется от 10 тыс. до десятков миллионов. Например, фермент рибонуклеаза имеет молекулярную массу 12500, каталаза – 500000.
Существуют различные методы определения молекулярной массы белков:
Метод диффузии основан на способности веществ диффундировать в какую-либо жидкость. Растворы белков с известной (М1) и неизвестной (Мх) молекулярной массой пропускают через мембрану. Белки с различной молекулярной массой диффундируют в жидкость с различной скоростью. Чем выше скорость диффузии белка, тем меньше его молекулярная масса.
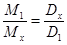 ,
,
где D1 и Dх – коэффициент диффузии белка с известной и неизвестной молекулярной массой соответственно.
Недостаток данного метода заключается в том, что необходимо иметь очищенные растворы белков.
Метод ультрафильтрации. Берут набор молекулярных “сит” или мембран, имеющих различный диаметр пор, и пропускают через них раствор белка. Белок, молекулярная масса которого больше диметра пор мембраны, задерживается на этой мембране. Белок с меньшей молекулярной массой проскакивает через неё и попадает на следующую мембрану с меньшим диаметром пор. Этот метод позволяет разделить белки по молекулярной массе.
Метод гель-фильтрации основан на том, что скорость прохождения молекул через колонку, заполненную гелем, прямо пропорциональна его молекулярной массе. Нанесенные на колонку соединения (в виде раствора в подвижной фазе) начинают взаимодействовать с гранулами геля, проникая в объем гранул через поры, что замедляет прохождение этих соединений по колонке. Молекулы меньших размеров легче проникают в объем гранулы через поры, что замедляет их движение. Молекулы с размерами, большими, чем размеры пор, совсем не будут проникать в гранулы и в виде раствора в подвижной фазе просто пройдут через колонку.
 По форме белковые молекулы могут быть: шаровидные, нитевидные, в виде эллипса. Форма белковой молекулы или степень глобулярности белка определяется отношение большой оси молекулы (в) к малой оси (а). Если в/а=1, то белки шаровидные – глобулины, если в/а=4 белки эллипсовидные – альбумины, в/а=200 фибриллярные белки (нитевидные). Глобулины содержатся в растениях, альбумины – белок куриного яйца, фибриллярные – эластин, коллаген.
По форме белковые молекулы могут быть: шаровидные, нитевидные, в виде эллипса. Форма белковой молекулы или степень глобулярности белка определяется отношение большой оси молекулы (в) к малой оси (а). Если в/а=1, то белки шаровидные – глобулины, если в/а=4 белки эллипсовидные – альбумины, в/а=200 фибриллярные белки (нитевидные). Глобулины содержатся в растениях, альбумины – белок куриного яйца, фибриллярные – эластин, коллаген.
III. Коллоидное состояние белковых растворов, растворимость, осаждение, денатурация.
Коллоидными являются растворы, размер частиц которых составляет 0,001-0,1мкм. О коллоидном характере белковых растворов свидетельствует эффект Тиндаля. Если перед источником света поместить экран со щелью, раствор соли или белка, затем темный экран и пропустить его через щель и раствор соли, то размер щели на темном экране будет таким же, как и в начальный момент. При прохождении света через раствор белка, лучи света отражаются от его молекул, рассеиваются и на противоположном экране образуется пятно большего размера. Это свидетельствует о том, что растворы белков являются коллоидными.
Специфическими свойствами белков являются растворимость, осаждение и денатурация.
Гидрофильность белков – способность связывать на своей контактной поверхности воду. Гидрофильные свойства (растворимость) белков обусловлены тем, что на поверхности белковой молекулы имеются ионизирующие группы:
R-CH-COOH
½
NH2
карбоксильная (-СООН) – притягивает 4 молекулы воды,
аминогруппа (-NH2) – притягивает 2 молекулы воды.
Водные растворы белков устойчивы, так как белковая глобула окружена гидратной оболочкой. Таким образом, гидрофильность белков представляет собой следствие действия электростатических сил притяжения, развивающихся между ионными и полярными группами белковой молекулы и диполями воды.
Если к раствору белка добавить какое-либо гидрофильное соединение, то частицы белка слипаются, раствор мутнеет и белок выпадает в осадок. Это явление называется осаждение белков. Осаждать белки можно органическими растворителями (ацетон, этиловый спирт, изопропиловый спирт, эфиром) или концентрированными растворами нейтральных солей. Процесс осаждение белков нейтральными солями называется высаливание.
Физический смысл осаждения заключается в том, что происходит разрушение гидратной оболочки, в результате чего белок выпадает в осадок. Если к образовавшемуся осадку добавить достаточное количество воды, то белок снова растворится, при этом он не утрачивает своих первоначальных физико-химических свойств. Таким образом, осаждение – обратимый процесс.
Денатурация – любое негидролитическое разрушение конформационной структуры белка, приводящее к изменению его физико-химических свойств. При этом происходит разрушение третичной структуры белка и потеря всех его первоначальных физико-химических свойств. Денатурацию вызывают следующие факторы:
физические: - интенсивное механическое встряхивание;
- действие УФ лучей;
- высокая температура;
химические: - концентрированные кислоты и щелочи;
- трихлоруксусная кислота;
- соли тяжелых металлов.
Денатурация является необратимым процессом. Её широко применяют в пищевой промышленности: при приготовлении кремов, выпечки хлеба, варки мяса, яиц, рыбы. Денатурированные белки легче усваиваются организмом человека.
IV. Белки – амфотерные электролиты.
Амфотерность – способность веществ проявлять свойства как кислоты, так и основания. Амфотерный характер белка обусловлен его химическим строением. Если раствор белка поместить в кислую среду, то он приобретет положительный заряд, в щелочную – отрицательный.
R-CH-COO- + Н+ ® R-CH-COOH + (n-1) Н+
½ ½
NH3+ NH 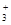
R-CH-COO- + ОН- ® R-CH-COO- + (n-1) ОН-
½ ½
NH3+ NH2
В водных растворах белок находится в виде цвиттер-иона:
R-CH-COO-
½
NH 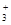
Растворы белков являются амфотерными электролитами. Можно подобрать такое значение рН среды при котором белок будет электронейтрален, то есть сумма его положительных зарядов равна сумме отрицательных зарядов. Такое значение рН называется изоэлектрической точкой (ИЭТ). Для каждого белка имеется свое значение ИЭТ. В ИЭТ белки обладают минимальной растворимостью, наименее устойчивы и легко выпадают в осадок, не перемешаются в электрическом поле.
Всем белкам присущи цветные реакции, указывающие на их химическое строение.
ХИМИЧЕСКОЕ СТРОЕНИЕ БЕЛКОВ
1. Аминокислотный состав белков. Реакционная способность белковой молекулы.
2. Физико-химические свойства аминокислот, входящих в состав белков.
3. Классификация аминокислот. Незаменимые аминокислоты.
4. Структура белковой молекулы.
5. Классификация белков.
I. Экспериментально было установлено, что белки состоят из аминокислот. В настоящее время известно около 160 аминокислот и только 20-22 входят в состав белков. От того, какие аминокислоты и в какой последовательности входят в состав белков зависят их физико-химические свойства и функции.
Все аминокислоты, которые входят в состав белков являются a-аминокислотами. Аминокислоты, вращающие плоскость поляризации вправо относятся к L-ряду, влево – D-ряду.
Данилевский предположил, что соединение отдельных аминокислот в молекуле белка происходит с помощью пептидных связей. В дальнейшем это предположение было обосновано Фишером, который развил полипептидную теорию строения белка. Аминокислоты в молекуле белка соединяются по средствам пептидной связи, которая образуется между карбоксильной группой одной аминокислоты и аминогруппой другой. По своей природе пептидная связь (- СО-NH-) является прочной ковалентной.
 |
Н3С-CH-COOH + CH2-COOН ® Н3С-CH-C- NH-CH2-COOН + H2O
½ ½ ½ ½½
NH2 NH2 NH2 O пептидная связь
аланин глицин аланилглицин
Две аминокислоты при взаимодействии друг с другом образуют дипептид, в названии которого та аминокислота, которая взаимодействует своей карбоксильной группой меняет окончание на –ил. Эти аминокислоты могут образовывать глицилаланин, но это будет уже совершенно новый дипептид с характерными ему свойствами и функциями.
Пептидная связь может существовать в кето- и енольной форме.
– С – N – ® – С = N –
½½ ½ ½
O Н ОН
кетоформа енольная форма
Две аминокислоты могут образовывать 2 дипептида,
три – 3! = 3×2×1= 6 трипептидов,
четыре – 4! = 4×3×2×1= 24 полипептида.
Реакционная способность белковой молекулы зависит от строения аминокислот, входящих в её состав.
II. Физико-химические свойства аминокислот, входящих в состав белков.
Все белки дают ряд характерных реакций:
1. Реакция Ван-Сляйка (с азотистой кислотой)
R-CH-COOH + HNO2 = R-CH-COOH + N2 + H2O
½ ½
NH2 OH
оксикислота
Эта реакция лежит в основе количественного определения белка по количеству выделившегося азота.
2. Взаимодействие со щелочами.
R-CH-COOH + NаOH = R-CH-COONа + H2O
½ ½
NH2 NH2
3. Реакция Зёренсена (с формальдегидом)
R-CH-COOH + H-C=O = R-CH-COOН + H2O
½ ½ ½
NH2 H N=СH2
Образовавшееся соединение оттитровывают щелочью. По количеству щелочи можно определить содержание аминокислот или белка. Эта реакция лежит в основе формольного титрования
R-CH-COOH + NаOH = R-CH-COONа + H2O
½ ½
N=СH2 N=СH2
4. Реакция этерификации (со спиртом)
R-CH-COOH + С2Н5OH = R-CH-COO С2Н5 + H2O
½ ½
NH2 NH2
5. Реакция с нингидрином
СН O O СН
/ \\ êê êê // \ O





 HC C ¾ C OH HO C ¾ C CH //
HC C ¾ C OH HO C ¾ C CH //
êê ½ C + R-CH-COOH ® C ½ êê + CO2 + R- C

 HC C ¾ C OH ½ H C ¾ C CH \
HC C ¾ C OH ½ H C ¾ C CH \
\ // êê OH êê \\ / H
СН O Аминокислота O CH альдегид
Нингидрин
СН O СН O O СН
/ \\ êê / \\ êê êê // \




 HC C ¾ C OH NH3 HC C ¾ C C ¾ C CH
HC C ¾ C OH NH3 HC C ¾ C C ¾ C CH


 êê ½ C ® êê ½ C H ¾ N = C ½ êê+ 3H2O + H+
êê ½ C ® êê ½ C H ¾ N = C ½ êê+ 3H2O + H+
 HC C ¾ C OH HC C ¾ C C ¾ C CH
HC C ¾ C OH HC C ¾ C C ¾ C CH
\ // êê \ // ½ êê \\ /
СН O СН O- O CH
Продукт с сине-фиолетовой окраской
7. Реакция Майера (реакция меланоидинообразования)
Меланоидины – окрашенные соединения, образующиеся в результате взаимодействия белков с восстановленными сахарами и альдегидами при вы-
сокой температуре. Эта реакция обуславливает цвет корки хлеба, цвет пива.
III. Классификация аминокислот
| АМИНОКИСЛОТЫ | |
 
| |
| Ациклические (неразветвленные) | Циклические (разветвленные) |
| 1. Моноаминомонокарбоновые | 5. Гомоциклические |
| 2. Моноаминодикарбоновые | 6. Гетероциклические |
| 3. Диаминомонокарбоновые | |
| 4. Диаминодикарбоновые |
1. Моноаминомонокарбоновые
Гликокол (глицин) Аланин
CH2-COOH H3C -CH-COOН
½ ½
NH2 NH2
1.1. Валин 1.2. Лейцин
H3C-CH-CH-COOH H3C-CH-СH2 -CH-COOН
½ ½ ½ ½
CH3 NH2 CH3 NH2
1.3. Изолейцин 1.4. Метионин
H3C- СH2-CH-СH2 -CH-COOН H3C-S-(СH2)2 -CH-COOН
½ ½ ½
CH3 NH2 NH2
1.5. Треонин
H3C-CH-CH-COOH
½ ½
ОH NH2
2. Моноаминодикарбоновые 3. Диаминомонокарбоновые
Аспарагиновая кислота 3.5 Лизин
HООC-CH2-CH-COOН CH2-(СH2)3-CH-COOН
½ ½ ½
NH2 NH2 NH2
4. Диаминодикарбоновые
Цистин (из 2-х молекул цистеина)
HOOC-CH- СH2 -S-S-СH2 -CH-COOН
½ ½
NH2 NH2
5. Гомоциклические 6. Гетероциклические
5.7. Фенилаланин 6.8. Триптофан
СН СН
// \ // \
HC C-СН2-СН-СООН C C¾ C-СН2-СН-СООН
½ êê ½ ½ êê êê ½
HC C NH2 HC C CH NH2
\\ / \\ / \ /
СН СН NH
8 из этих аминокислот относятся к незаменимым, так как они не синтезируются в организме человека, а поступают из вне с пищей. Пищевая ценность белков характеризуется содержанием в них незаменимых аминокислот.
В мировой практике принято пищевую ценность белков сравнивать с пищевой ценность казеина молока и яичного альбумина, так как они являются полноценными, содержат все незаменимые аминокислоты в достаточном количестве. Белки, содержащие все незаменимые аминокислоты называются полноценными. В основном это белки животного происхождения.
По усвояемости и пищевой ценности белки характеризуются следующими показателями: белки мяса и рыбы – 90%, пшеницы и ячменя – 60-70%, бобовых культур около 70%.
Чтобы определить аминокислотный состав белков проводят его гидролиз и анализируют состав гидролизата.
IV. Структура белковой молекулы.
Все белки как минимум имеют три уровня структуры, некоторые - четыре.
Первичная структура – каркас белковой молекулы представляет собой полипептидную цепь, состоящую из аминокислот, соединенных пептидными связями. В формировании первичной структуры участвуют ковалентные связи.
R1-CH-CO-NH-CH2-CO-NH-CH-CO-NH-CH-COOН
½ ½ ½ ½
NH2 R2 R3 R4
От её строения (аминокислотной последовательности) зависят физико-химические свойства белка.
Вторичная структура представляет собой a-спираль, которая возникает в пределах одной полипептидной цепи, или b-складчатую структуру, образующуюся между смежными плипептидными цепями.
Дата добавления: 2016-12-09; просмотров: 3105;











