Технические характеристики отдельных видов топлив
Твердое топливо
Выход летучих веществ. Если твердое топливо постепенно нагревать в инертной среде без доступа воздуха, то при высоких температурах сначала выделяются водяные пары, а затем происходит разложение кислородосодержащих молекул топлива с образованием газообразных веществ, получивших название летучие вещества (СО, Н2, СО2, СmHn, H2S, CN и др.).
Выход летучих веществ из твердых топлив происходит в интервале температур от 160 до 1100 °С и определяется содержанием кислорода в топливе:
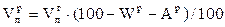 . (3.6)
. (3.6)
Летучие вещества, выделившиеся из топлива, обеспечивают более раннее воспламенение оставшейся твердой частицы, так как летучие вещества воспламеняются при более низкой температуре (350¸600 °С), чем твердый остаток (950¸1000 °С), и нагревают твердую частицу до воспламенения. Влияние летучих веществ существенно на начальной стадии горения топлива: чем выше выход летучих веществ, тем быстрее воспламеняется топливо и тем глубже оно выгорает. В связи с этим выход летучих веществ оказывает непосредственное влияние на организацию топочного процесса, выбор объема топочной камеры, эффективность (полноту) сжигания топлива.
Структура кокса. Твердый остаток, который получается после нагревания топлива (без доступа окислителя) и выхода летучих веществ называется коксом. В состав кокса входят остаточный углерод и зола. При низких температурах в твердом остатке кроме золы может оказаться часть элементов (C, H, Sл, N). Тогда твердый остаток называется полукоксом.
По своим механическим свойствам кокс может быть порошкообразным, слабоспекшимся и спекшимся. В зависимости от выхода летучих веществ и характеристики кокса каменные угли разделяются на 10 марок: длиннопламенный - Д, газовый - Г, газовый жирный – ГЖ, жирный – Ж, коксовый жирный - КЖ, коксовый - К, коксовый второй – К2, отощенный спекающийся – ОС, слабоспекающийся–СС, тощий – Т.
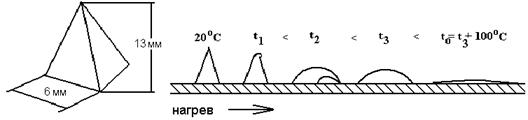
Температурные характеристики золы. Поскольку золовые частицы представляют собой смесь минералов с различной температурой их плавления, состояние золы при высокотемпературном нагреве характеризуется следующими температурными точками: t1 - начало деформации золовой пирамидки; t2 - начало размягчения золы;
t3 - температура жидкоплавкого состояния золы, t0 - температура истинно жидкого состояния.
Мазут.
Важнейшей технической характеристикой, определяющей текучесть и условия применения мазута, является вязкость, которая существенно зависит от температуры и оказывает сильное влияние на продолжительность сливно-наливных операций, эффективность транспортировки по трубопроводам, качество распыления мазута перед сжиганием в топках и полноту его сжигания, а также на способность отстаивать содержащуюся в нем воду.
Плотность. Обычно пользуются относительной плотностью мазута (плотностью по отношению к плотности воды при температуре 20°С), которая составляет r20 = 0,99¸1,06.
Температура вспышки и воспламенения - это температура, при которой пары мазута над поверхностью жидкой фазы кратковременно воспламеняются при поднесении источника огня. Температурой воспламенения считается такая температура паров в смеси с воздухом, при которой после вспышки продолжается устойчивое горение не менее 5 секунд. Эта температура обычно на 15-20°С выше, чем при вспышке. Мазут, сжигаемый на электростанциях, имеет температуру вспышки 135¸245°С, поэтому во избежание пожара температура подогрева мазута в открытых системах всегда должна быть ниже температуры вспышки (£10°С).
Газ.
Плотность. Почти все виды газового топлива легче воздуха, поэтому проникший в помещение газ скапливается под верхними перекрытиями.
В целях безопасности перед пуском котла проверяют отсутствие газа в вероятных местах его скопления.
Взрываемость. Смесь горючего газа с воздухом в определенных пропорциях при вводе в эту смесь источника огня может взорваться. Взрывоопасные концентрации горючего газа в воздухе зависят от химического состава и свойств газа. При этом выделяют нижний предел взрываемости и верхний предел взрываемости (наибольшая концентрация газа в воздухе), между которыми смесь газа с воздухом взрывоопасна.
Токсичность. Под токсичностью понимают способность газового топлива вызывать отравление. Наиболее опасными в этом отношении компонентами являются оксид углерода (СО) и сероводород (H2S). Предельно допустимая концентрация СО в воздухе составляет 0,0024 % (0,03 мг/л), а опасна для жизни 0,4 % (при воздействии в течение 5¸6 минут).
Сернистые соединения в большинстве природных газов практически отсутствуют. В природном газе все его компоненты перемешаны равномерно и если состав газа известен, то концентрацию в воздухе вредных газов можно установить по присутствию в воздухе метана, процентное содержание которого определяют прибором - метаномером. Почти все природные газы совсем не имеют запаха или имеют весьма слабый запах. Для своевременного обнаружения утечки газа и принятия мер безопасности газовое топливо до поступления в газовую магистраль «одорируют», т.е. придают характерный острый запах введением сернистого соединения - меркаптана.
Лекция
Горение энергетического топлива. Выход и состав продуктов полного сгорания топлива. Определение коэффициента избытка воздуха.
Горение топлива
Горение топлива – химическая реакция соединения горючих элементов топлива с окислителем при высокой температуре, сопровождающийся интенсивным выделением теплоты:
С+О2=>СО2 + Qc↑; 2Н2+О2=>2Н2О + QH2↑; S+О2=>SO2 + QS2↑. (4.1)
  Горение Горение
| |
| полное (образуются продукты СО2, Н2О, SO2) | неполное (дополнительно образуются СО, Н2, СН4) |
Процессы горения разделяют на 2 группы: гомогенное горение
(горение газообразных горючих) и гетерогенное горение (горение твердых и жидких горючих). Причины неполноты горения: локальный недостаток окислителя: С+0,5О2=>СО; температура газов <1000 ºС, или >2000 ºС; недостаточный контакт горючих элементов и окислителя.
Процесс горение твердого топлива состоит из следующих стадий:
1) подсушка топлива и нагревание до температуры начала выхода летучих веществ; 2) воспламенение летучих веществ и их выгорание; 3) нагревание кокса до воспламенения; 4) выгорание горючих веществ из кокса.
Горение жидкого топлива. Основным жидким топливом, используемым в теплоэнергетике и промышленной теплотехнике, является мазут.
В установках небольшой мощности также используют смесь технического керосина со смолами. Наибольшее применение получил метод сжигания в распыленном состоянии. Этот метод позволяет значительно ускорить его сгорание и получить высокие тепловые напряжения объемов топочных камер вследствие увеличения площади поверхности контакта топлива с окислителем.
Процесс горения жидкого топлива можно разделить на следующие стадии: нагревание и испарение топлива; образование горючей смеси; воспламенение горючей смеси от постороннего источника (искры, раскаленной спирали и т.п.); собственно горение смеси.
Горючие вещества топлива взаимодействуют с кислородом воздуха в определенном количественном соотношении. Расход кислорода и количество получающихся продуктов сгорания рассчитывают по стехиометрическим уравнениям горения:
- при полном сгорании углерода образуется: С+О2=СО2 Þ, исходя из молекулярной массы, получим: 1кг С + 2,67 кг О2 = 3,67 кг СО2;
- при окислении (горении) водорода: 2Н2+О2=2Н2О Þ, исходя из молекулярной массы, получим: 1кг Н2 +5,6 м3 О2= 11,2 м3 Н2О;
- при горении серы образуется: S+O2=SO2 Þ, исходя из молекулярной массы, получим: 1кг S + 0,7 м3 O2 = 0,7 м3 SO2.
Теоретическое количество воздуха, необходимого для полного сгорания
1 кг топлива, определяется по следующей формуле:
Vо = 0,0889 (Ср + 0,375Sлр ) + 0,265 Нр – 0,033Ор, м3/кг. (4.2)
Теоретическое количество воздуха, необходимого для сжигания газа:
Vо =0,0476 (0,5СО + 0,5Н2 +1,5Н2S + ∑(m + n/4)CmHn - O2), м3/м3, (4.3)
то есть Vо представляет собой минимальное количество воздуха, необходимое для обеспечения полного сгорания 1 кг (1м3) топлива при условии, что при горении используется весь содержащийся в топливе и подаваемый вместе с воздухом кислород. В реальных условиях из-за технических трудностей ощущается местный недостаток или избыток окислителя (воздуха), в результате ухудшается полное горение топлива. Поэтому воздух подается в большем количестве по сравнению с его теоретическим количеством Vов.
Отношение действительного количества воздуха (Vв), подаваемого в топку, к теоретически необходимому количеству называется коэффициентом избытка воздуха:
a = Vв / Vов (1,02¸1,7). (4.4)
Коэффициент избытка воздуха на выходе из топочной камеры обозначается aт. Доля избыточного воздуха в топке зависит от сорта топлива, способа его сжигания и конструкции топочного устройства.
Уменьшение a дает экономию расхода энергии на тягодутьевых устройствах и повышает КПД котла. Однако его снижение ниже расчетного значения aт ведет к росту недожога топлива и снижению экономичности котла. За счет присоса воздуха объем продуктов сгорания по газовому тракту постепенно увеличивается, снижается температура газов. Присосы определяются в долях от теоретически необходимого объема воздуха:
∆ai = ∆Vi /Vво, (4.5)
где DVi - объем присосанного воздуха в пределах i-ой поверхности парового котла.
Тогда избыток воздуха за i-ой по порядку поверхностью нагрева после топки определяется как:
ai = aт + S∆ai. (4.6)
В топочной камере также имеют место присосы воздуха Daт, с учетом этого избыток воздуха в зоне горения будет составлять:
aгор = aт - ∆aт. (4.7)
Дата добавления: 2019-09-30; просмотров: 942;











