Выделение чистой культуры из отдельной колонии
Основным методом выделения чистых культур микроорганизмов до настоящего времени является метод, предложенный Р. Кохом. Принцип его заключается в получении чистой культуры из отдельной колонии. Однако этот метод неприменим для выделения микроорганизмов, которые не растут или плохо растут на плотных средах. К числу таких микроорганизмов относятся некоторые бактерии, многие водоросли и простейшие.
При выделении чистой культуры аэробных микроорганизмов накопительную культуру высевают на поверхность плотной среды. Порядок работы следующий. Расплавленную на кипящей водяной бане стерильную питательную среду, содержащую агар или желатину, разливают в стерильные чашки Петри. После того, как среда застынет, на ее поверхность из пипетки наносят каплю накопительной культуры или ее разведения в стерильной воде и стерильным стеклянным шпателем Дригальского распределяют каплю сначала по одной половине поверхности среды в чашке Петри, затем по второй половине, после чего этим же шпателем протирают поверхность плотной среды последовательно во 2-й, 3-й и 4-й чашках. Обычно в первых двух чашках после инкубации наблюдают сплошной рост микроорганизмов, тогда как в последующих - изолированные колонии (рис. 91). Рассевать накопительную культуру можно петлей методом истощающего штриха. В этом случае накопительную культуру или ее разведение отбирают петлей и на поверхности плотной среды проводят штрихи в таком порядке, как указано на рис. 50. Перед каждым новым штрихом петлю стерилизуют в пламени горелки.
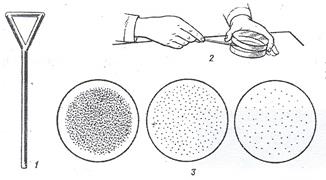
Рисунок 50. Рассев культуры микроорганизмов на поверхность плотной среды шпателем: 1 - шпатель Дригальского; 2 - рассев; 3 – рост микроорганизмов после рассева
После посева чашки помещают в термостат крышками вниз, чтобы
конденсационная вода, образовавшаяся на крышке чашки Петри при
застывании агара, не помешала получить изолированные колонии. Чашки выдерживают в термостате в течение 1-7 суток в зависимости от скорости роста микроорганизмов. Выросшие изолированные колонии отсевают петлей на поверхность скошенной плотной среды в пробирки или в жидкую среду.
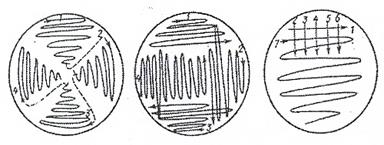
Рисунок 51. Схема рассева культуры микроорганизмов на поверхность плотной среды петлёй
Изолированные колонии аэротолерантных микроорганизмов и факультативных анаэробов чаще получают методом глубинного посева. Для этого плотную питатетельную среду предварительно разливают в пробирки по 15-20 мл и стерилизуют. Непосредственно перед посевом пробирки помещают в кипящую водяную баню, чтобы среда расплавилась. Высев проводят из разведений накопительной культуры в стерильной водопроводной воде. Разведения готовят с таким расчетом, чтобы при высеве 0,5-1,0 мл разведения получить изолированные колонии. Степень разведения определяется плотностью накопительной культуры. Высевы делают, как правило, из трех-четырех последних разведений. Для этого в пробирку с расплавленной и остуженной до 48-50°С агаризованной средой вносят 0,5-1,0 мл одного из разведений накопительной культуры. Посевной материал тщательно перемешивают, вращая пробирку между ладонями. Затем около пламени горелки вынимают из пробирки пробку, обжигая края пробирки в пламени горелки, и быстро выливают содержимое пробирки в чашку Петри. После того как агаризованная среда застынет, чашки Петри помещают в термостат. Колонии, выросшие в толще среды, вырезают стерильным скальпелем или извлекают стерильными капиллярными трубками или просто петлей и переносят в жидкую среду, благоприятную для развития выделяемых микроорганизмов.
Особые трудности возникают при выделении чистых культур облигатных анаэробов. Если контакт с молекулярным кислородом не вызывает сразу же гибели клеток, то посев проводят на поверхность среды в чашки Петри, но после посева чашки тотчас помещают в анаэростат. Однако чаще пользуются методом разведения. Сущность его заключается в том, что разведения накопительной культуры проводят в расплавленной и охлажденной до 45-50°С агаризованной питательной среде. Делают 6-10 последовательных разведений. Затем среду в пробирках быстро охлаждают и заливают поверхность слоем стерильной смеси парафина и вазелинового масла (соотношение 3: 1), что препятствует проникновению воздуха в толщу агаризованной среды (рис. 52).
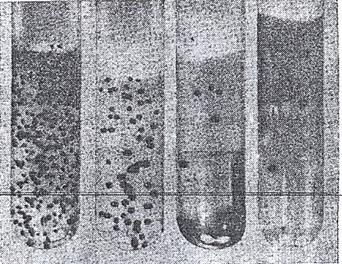
Рисунок 52. Изолированные колонии анаэробных бактерий, полученные методом разведения
Иногда агаризованную питательную среду после посева и тщательного перемешивания переносят в стерильные трубки Бурри . Можно использовать капиллярные пипетки Пастера, в которые набирают соответствующее разведение накопительной культуры в расплавленной агаризованной питательной среде. Конец капилляра запаивают. При удачно выбранном разведении накопительной культуры в одной из пробирок (пипеток Пастера, трубок Бурри) вырастают изолированные колонии. Чтобы извлечь образовавшиеся колонии, поступают следующим образом. Удаляют стерильной иглой слой парафина и вазелинового масла, а столбик агаризованной среды осторожно выдувают из пробирки в стерильную чашку Петри, пропуская газ, не содержащий кислорода, через капилляр, который помещают между стенкой пробирки и агаризованной средой. Агаризованную среду из трубки Бурри выдувают, пропуская газ через ватную пробку.
Иногда плотную среду из пробирки извлекают иначе. Пробирку слегка нагревают, всё время быстро вращая ее над пламенем горелки. При этом агар, непосредственно прилегающий к стенке, плавится и содержимое пробирки в виде агарового столбика легко выскальзывает в стерильную чашку Петри. Столбик агара разрезают стерильным ланцетом и извлекают колонии, захватывая их стерильными капиллярными трубками или петлей. Можно также вырезать их стерильным ланцетом. Извлеченные колонии переносят в жидкую среду, благоприятную для развития выделяемых микроорганизмов. Если изолированные колонии получены в капилляре, то после тщательной дезинфекции поверхности его разламывают стерильным пинцетом и участки капилляра, содержащие изолированные колонии, переносят в стерильную среду.
Для получения изолированных колоний методом глубинного посева и методом разведений рекомендуется использовать осветленные питательные среды.
Когда хотят получить изолированные колонии облигатных анаэробных бактерий, характеризующихся особенно высокой чувствительностью
к кислороду (экстремальные анаэробы), используют метод вращающихся пробирок Хангейта. Сущность этого метода заключается в следующем. Расплавленную агаризованную среду заражают при постоянном токе через пробирку инертного газа, освобожденного отпримеси кислорода. Затем пробирку закрывают резиновой пробкой и помещают горизонтально в зажим, вращающий пробирку. Агаризованная среда при этом равномерно распределяется по стенкам пробирки и застывает тонким слоем. Применение тонкого слоя агаризованной среды в пробирке, заполненной газовой смесью, позволяет получить изолированные колонии, хорошо видимые невооруженным глазом (рис. 53).
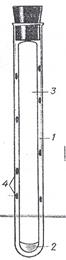
Рисунок 53. Изолированные колонии облигатных анаэробов в пробирках, заполненных газом (по Хангейту): 1 – агаризованная питательная среда; 2 – конденсационная вода; 3 – смесь газов Н  и СО
и СО  ; 4 – колонии бактерий
; 4 – колонии бактерий
В некоторых случаях бывает достаточно одного посева в плотную среду, чтобы получить чистую культуру. Однако чаще посев в плотную питательную среду повторяют два-три раза. В качестве посевного материала при этом используют культуру, полученную из отдельной колонии.
Дата добавления: 2021-02-19; просмотров: 785;











