Железоуглеродистых сплавов
Диаграммы состояния систем конкретных компонентов (например, «Железо – углерод», «Медь – алюминий» и др.) редко являются простейшими (типовыми) диаграммами. Они, как правило, являются сложными (комбинированными) диаграммами, в строении которых нужно уметь выделить простейшие (типовые) части их.
Рассмотрим диаграмму состояния «Железо – углерод (цементит)»
(«Fe – Fe3C») (рис. 3.2), основными компонентами которой являются железо и углерод. Температура плавления железа 1539 °С. В твердом состоянии оно может находиться в двух модификациях: α (решетка ОЦК) и γ (решетка ГЦК). Модификация Feα существует при температурах до 911 °С и от 1392 до 1539 °С. Важной особенностью Feα является его ферромагнетизм ниже температуры 768 °С (точка Кюри). Модификация Feγ существует в интервале температур 911–1392 °С.
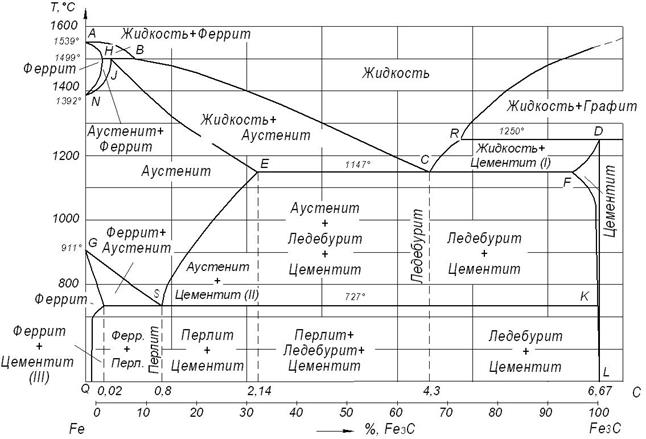
Рис. 3.2. Диаграмма «Железо – углерод (цементит)»
Углерод имеет ряд полиморфных модификаций: графит, алмаз, карбин, фуллерен, графен и другие.
Графит – минерал из класса самородных элементов. Структура слоистая, состоят из шестиугольных слоев атомов углерода.
Графит хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1–2 по шкале Мооса). Плотность 2,08–2,23 г/см³. Цвет серый, блеск металлический. Устойчив при нагревании в отсутствие воздуха (температура плавления графита под давлением свыше 100 атм. – около плюс 4000 °C).
Главные отличительные черты алмаза – высочайшая среди минералов твёрдость, наиболее высокая теплопроводность среди всех твердых тел. Алмаз является диэлектриком. У алмаза очень низкий коэффициент трения по металлу на воздухе – всего 0,1, что связано с образованием на поверхности кристалла тонких пленок адсорбированного газа, играющих роль своеобразной смазки. Когда такие пленки не образуются, коэффициент трения возрастает и достигает 0,5–0,55. Низкий коэффициент трения обусловливает исключительную износостойкость алмаза на стирание. Для алмаза также характерны самый высокий (по сравнению с другими известными материалами) модуль упругости и самый низкий коэффициент сжатия.
Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9–2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин – линейный полимер углерода. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано его практическое применение – в фотоэлементах.
Другой модификацией элементарного углерода является фуллере́н – молекулярное соединение, представляющее собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Применяются фуллерены как полупроводники (при легировании как сверхпроводники), в оптической технике, при создании лекарств и искусственных алмазов.
Графе́н − двумерная полиморфная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных в гексагональную двумерную кристаллическую решётку. Его можно представить как одну плоскость графита, отделённую от объёмного кристалла. Графен обладает большой механической жёсткостью и хорошей теплопроводностью (~1 ТПа и ~5×103 Вт/(м·К) соответственно). Высокая подвижность носителей заряда делает его перспективным материалом для использования в самых различных приложениях, в частности, как будущую основу наноэлектроники и возможную замену кремния в интегральных микросхемах.
Железо с углеродом образует растворы внедрения. Растворимость углерода в железе зависит от температуры и от того, в какой кристаллической форме существует железо. Твердый раствор углерода в Feα называется ферритом,а в Feγ – аустенитом.
Содержание углерода в диаграмме «Железо – углерод» ограничивается 6,67 %, так как при этой концентрации образуется химическое соединение Fe3C –цементит. Так как на практике применяют железоуглеродистые сплавы с содержанием углерода не более 5 %, то цементит является вторым компонентом рассматриваемой диаграммы. Цементит – неустойчивое химическое соединение, и при определенных условиях он распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение для получения высокоуглеродистых сплавов – серых чугунов.
Координаты характерных точек диаграммы «Железо – цементит» приведены в таблице 3.1
Превращения в сплавах системы «Fe – Fe3C» происходят как при затвердевании жидкой фазы, так и в твердом состоянии.
Первичная кристаллизация идет в интервале температур, определяемых линиями ABCR (ликвидус) и AHIECFD (солидус). Вторичная кристаллизация вызвана превращением железа одной модификации в другую и переменной растворимостью углерода в аустените и феррите, при понижении температуры растворимость уменьшается. Избыток углерода из твердых растворов выделяется в виде цементита. Линии ES и PQ характеризуют изменение концентрации углерода в аустените (ES) и феррите (PQ).
Таблица 3.1
Дата добавления: 2016-11-04; просмотров: 2444;











