Объемы и состав продуктов сгорания
При проектировании теплотехнических агрегатов нужно знать количество образующихся газов, чтобы правильно рассчитать газоходы, дымовую трубу, выбрать устройство (дымосос) для удаления этих газов и т. д. Как правило, количества продуктов сгорания (как и подаваемого воздуха) относят на единицу топлива (на 1 кг для твердого и жидкого и на 1 м3 в нормальных условиях для газа). Их рассчитывают исходя из уравнения материального баланса горения. Для грубых оценок можно считать, что в нормальных условиях объем продуктов сгорания 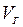 твердого и жидкого топлив равен объему воздуха
твердого и жидкого топлив равен объему воздуха 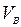 , а газообразного топлива
, а газообразного топлива 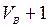 , ибо объем основной составляющей дымовых газов — азота, так же как и «избыточного» кислорода, при горении не меняется. В реакциях C + O2 = CO2, S + O2 = SO2 объем газов тоже остается постоянным. Для более точных расчетов необходимо все же учитывать, что при сжигании твердого топлива
, ибо объем основной составляющей дымовых газов — азота, так же как и «избыточного» кислорода, при горении не меняется. В реакциях C + O2 = CO2, S + O2 = SO2 объем газов тоже остается постоянным. Для более точных расчетов необходимо все же учитывать, что при сжигании твердого топлива 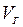 >
> 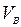 (обычно на 15—25 %) прежде всего из-за испарения содержащейся в нем влаги, а также из-за образования во
(обычно на 15—25 %) прежде всего из-за испарения содержащейся в нем влаги, а также из-за образования во 




 дяного пара при сгорании водородсодержащих соединений.
дяного пара при сгорании водородсодержащих соединений.
При полном сгорании
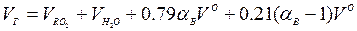
Здесь 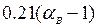 — избыточный кислород воздуха, «транзитом» проходящий в продукты сгорания;
— избыточный кислород воздуха, «транзитом» проходящий в продукты сгорания; 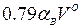 — азот воздуха, также проходящий «транзитом» (азотом топлива пренебрегаем);
— азот воздуха, также проходящий «транзитом» (азотом топлива пренебрегаем); 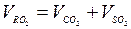 — объем сухих трехатомных продуктов сгорания.
— объем сухих трехатомных продуктов сгорания.
Поскольку при сгорании 1 кмоля углерода и серы (соответственно 12 и 32 кг) по реакциям образуется по 1 кмолю CO2 и SO2, а объем 1 кмоля идеального газа в нормальных условиях равен 22,4 м3, то объем трехатомных продуктов сгорания, м3/кг, можно записать
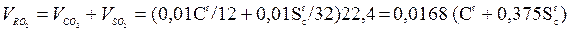
При сгорании 1 кг водорода по реакции образуется 9 кг водяного пара, кроме того, испаряется и влага топлива. В идеально-газовом приближении плотность водяного пара в нормальных условиях равна 18/22,4 = 0,805 кг/м3. Водяным паром, содержащимся в воздухе (около 10 г на 1 м3), можно пренебречь. Следовательно,
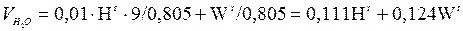
Для всех топлив СССР значения 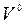 ,
, 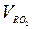 и
и 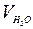 табулированы.
табулированы.
Приведенные формулы позволяют рассчитать также состав продуктов сгорания, т. е. процентное содержание в нем отдельных компонентов, например концентрацию кислорода 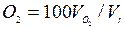 , водяного пара
, водяного пара 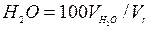 и т.д.
и т.д.
ЛЕКЦИЯ 18
Дата добавления: 2016-11-04; просмотров: 1403;











