Типы химических связей
Основными типами химической связи являются: ковалентная, ионная, металлическая и поляризационная связь (или связь Ван-дер-Ваальса).
Ковалентная связь. Ковалентная связь образуется между атомами одного или нескольких химических элементов с близкими ионизационными потенциалами. В чистом виде ковалентная связь реализуется при взаимодействии элементов с наполовину заполненными электронными оболочками. Из квантовой химии следует, что система из положительно заряженного ядра и отрицательно заряженных электронных оболочек имеет минимальную энергию в том случае, когда электронные оболочки заполнены полностью. Для этого внешняя оболочка атома должна содержать восемь электронов. Поэтому атомы с почти заполненной оболочкой стремятся присоединить недостающие электроны, а атомы, имеющие один - два электрона на внешней оболочке, – отдать лишние электроны. Атомы, имеющие наполовину заполненные электронные оболочки, обмениваются электронами. При этом образуются пары электронов с противоположно направленными спиновыми магнитными моментами. Причем эти пары принадлежат обоим соседним атомам, поэтому оболочки соседних атомов заполняются до устойчивой конфигурации (рис. 1.3).
Появление между положительно заряженными ионами отрицательно заряженной электронной пары приводит к тому, что оба иона притягиваются к обобществленным электронам и тем самым притягиваются друг к другу. Каждый атом взаимодействует с несколькими соседями, причем число соседей равно числу валентных электронов атома. Следовательно, ковалентная связь насыщена. Кроме того, атом взаимодействует только с теми соседями, с которыми он обменялся электронами, т. е. ковалентная связь направленна.
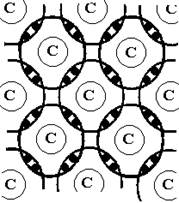 Рис. 1.3. Схема обра-зования ковалент-ной связи
Рис. 1.3. Схема обра-зования ковалент-ной связи
|
Отношение размера положительно заряженного ядра к размеру валентной электронной оболочки чрезвычайно мало, поэтому при анализе силы притяжения можно считать, что взаимодействуют точечные заряды, т. е. сила притяжения описывается простым кулоновским законом: сила притяжения обратно пропорциональна квадрату расстояния между зарядами. При сближении атомов начинается взаимное отталкивание внутренних электронных оболочек, и такое взаимодействие описывается более сложным законом: сила отталкивания обратно пропорциональна расстоянию между атомами в степени n, где n >2.
Увеличение порядкового номера элемента ведет к росту количества электронных оболочек, экранирующих взаимодействие положительно заряженных ядер с валентными электронами. Поэтому снижается сила взаимного притяжения и уменьшается глубина потенциальной ямы. В результате с ростом порядкового номера элемента уменьшается температура плавления, модуль упругости, а коэффициент теплового расширения растет.
Ионная связь. Ионная связь образуется при взаимодействии атомов с малым количеством валентных электронов и атомов с большим количеством электронов на валентных оболочках. При этом энергетически выгодно, когда наружные электроны атомов с низкими потенциалами ионизации переходят на валентные оболочки атомов с высокими ионизационными потенциалами. В результате образуются положительно и отрицательно заряженные ионы, взаимно притягивающиеся электростатическими силами (рис. 1.4). Ионная связь ненасыщенна, поскольку каждый из отрицательно заряженных ионов притягивает к себе положительно заряженные, а каждый из положительно заряженных ионов притягивает к себе все отрицательно заряженные. Однако ионная связь направленна, поскольку ион притягивает к себе разноименно заряженные ионы и отталкивает одноименно заряженные.
 Рис. 1.4. Схема образования ионной связи
Рис. 1.4. Схема образования ионной связи
|
Уменьшение размера иона и увеличение его заряда ведет к росту энергии связи, а следовательно, к росту температуры плавления материала, уменьшению коэффициента теплового расширения и к увеличению модуля упругости.
 Рис. 1.5. Схема образования металлической связи
Рис. 1.5. Схема образования металлической связи
|
Металлическая связь образуется между атомами одного или нескольких химических элементов, у которых валентные электронные оболочки застроены меньше, чем наполовину. Поскольку энергия иона минимальна при полностью заполненной внешней оболочке, атомы отдают внешние валентные электроны и превращаются в положительно заряженные ионы, между которыми находятся свободные электроны (электрон-ный газ) (рис. 1.5).
Каждый из положительно заряженных ионов притягивается к свободным электронам, и тем самым ионы притягиваются друг к другу. Металлическая связь ненаправленна и не насыщена. Такая особенность связи приводит к тому, что число ближайших соседей у иона может быть большим и определяется в основном геометрическими и энергетическими факторами. Поэтому кристаллические решетки металлов упакованы плотно. Такая плотно упакованная решетка металлов является причиной их высокой пластичности. Другим отличительным свойством металлической связи является наличие свободных электронов. Под действием электрического поля не связанные с ионами электроны перемещаются, вследствие чего все металлы обладают хорошей электропроводностью. Далее , свободные электроны могут легко ускоряться и замедляться, т. е. менять свою кинетическую энергию. Значит металлические материалы могут поглощать кванты электромагнитного поля любой энергии, т. е. металлы непрозрачны для радио- и световых волн. Поглотив квант электромагнитного поля, свободный электрон возбуждается и, переходя в стационарное состояние, испускает аналогичный квант. Иначе говоря, металлические материалы отражают радио- и световые волны.
Эти важнейшие качества , присущие металлам, отражены в очень кратком и емком определении, данном великим русским ученым М.В. Ломоносовым: «Металлы суть светлые тела, кои ковать можно".
Поляризационная связь, или связь Ван-дер-Ваальса. Образуется при сближении нейтральных молекул или атомов инертных газов. Рассмотрим возникновение поляризационной связи на примере атомов инертных газов.
 У одиночного атома электронная оболочка симметрична. При сближении двух атомов их электронные оболочки электрически взаимодействуют и деформируются (рис. 1.6). В итоге атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек, а следовательно, связь валентных электронов с ядром ослабевает и деформировать оболочки становится легче. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.
У одиночного атома электронная оболочка симметрична. При сближении двух атомов их электронные оболочки электрически взаимодействуют и деформируются (рис. 1.6). В итоге атомы превращаются в диполи, которые взаимно притягиваются. Чем больше порядковый номер атома, тем больше у него электронных оболочек, а следовательно, связь валентных электронов с ядром ослабевает и деформировать оболочки становится легче. Следовательно, возрастает дипольный момент атома и увеличивается энергия связи между атомами. Поэтому температура кипения тяжелых инертных газов заметно выше температуры кипения легких газов.
 Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Аналогичные процессы происходят и при сближении электрически нейтральных молекул. Причем чем выше молекулярный вес, тем больший дипольный момент молекул и выше энергия связи. Поэтому вещества с низким молекулярным весом при комнатной температуре являются газами, вещества с большим молекулярным весом - жидкостями, а вещества с еще большим молекулярным весом - твердыми телами.
Табл. 1.2 иллюстрирует прочность разных типов связи. Прочность связи характеризуют энергией , которую необходимо затратить для разрыва всех связей в одном моле вещества. Наиболее прочная связь ковалентная, несколько слабее ионная, далее металлическая, и очень слабая по сравнению с другими поляризационная.
Таблица 1.2
| Тип связи | Ковалентная | Ионная | Металли-ческая | Поляриза-ционная | ||||
| Кристалл | SiC | C алмаз | LiF | NaCl | Fe | Na | Ar | CH4 |
| Энергия связи, кДж/моль | 7,5 |
Основные свойства материала определяются типом и энергией химической связи. Например, углерод с четырьмя прочными ковалентными связями образует очень жесткую кристаллическую решетку алмаза. Этот кристалл является самым твердым природным материалом.
Тот же углерод может существовать также в виде графита. В кристалле графита три внешних электрона атома образуют ковалентную связь, эти связи обусловливают сцепление атомов в прочные атомные плоскости или слои. Четвертый внешний электрон идет на образование металлической связи, таким образом, графит хорошо проводит электрический ток. Образованные ковалентной связью атомные плоскости сцеплены между собой очень слабой поляризационной связью, вследствие чего графит является одним из самых мягких кристаллов. Его атомные слои легко скользят относительно друг друга и отслаиваются при небольшом механическом усилии. Именно такой процесс происходит, когда мы проводим графитовым грифелем карандаша по поверхности бумаги. Оставшиеся слои, чешуйки на поверхности бумаги и есть карандашный след.
Таким образом, у одного элемента или соединения могут существовать несколько видов кристаллов, а в одном и том же материале одновременно могут реализовываться несколько типов химических связей.
В ряде случаев наблюдается изменение типа связи при изменении внешних условий. Так, олово является элементом четвертой группы, и в нем должна реализовываться ковалентная связь, но у олова пять электронных оболочек, и валентные электроны слабо связаны с ядром. Поэтому при термическом возбуждении электроны отрываются от атомов и связь становится металлической. До температуры 13°С межатомная связь в олове ковалентная, и оно является типичным полупроводником - «серое» олово. Выше 13°С связь становится металлической, и олово ведет себя как типичный металл – «белое» олово. Важно отметить, что превращение белого олова в серое олово не может произойти строго при 13°С. Это вызвано существенным различием в плотности упаковки атомов (~25%). При перестройке кристаллических решеток в материале появляются упругие напряжения, которые повышают энергию системы. Поэтому превращение начинается при сильном переохлаждении. Упругие напряжения, возникающие при превращении, разрушают материал, и серое олово после такого превращения получается в виде порошка. Такое явление наблюдали уже давно в царской армии: при сильных морозах солдатские оловянные пуговицы, ложки и др. рассыпались в серый порошок. Не зная его причины, это называли «оловянной чумой». Она же стала причиной гибели экспедиции Роберта Скотта к Южному полюсу в 1912 году. Поскольку канистры с горючим были пропаяны оловом, то при сильном охлаждении во время антарктических морозов белое олово превратилось в серое и горючее вытекло.
Другим примером изменения типа связи является углерод. Он может существовать в модификации алмаза или графита. При нагреве алмаза до 1000 оС он с заметной скоростью переходит в графит. Но если создать чудовищное давление порядка 100000 атм и температуру 2000 оС, то устойчивой становится более плотная структура алмаза (rалм =3500кг/м3, rграф =2250 кг/м3). В 1955 году в американской лаборатории «Дженерал электрик» впервые были получены искусственные алмазы размером ~1 мм. Вслед за этим в 1961 году синтез алмазов был освоен и в Советском Союзе.
Дата добавления: 2016-11-04; просмотров: 2784;











