Радикальное замещение.
Ответ:
В молекулах алканов связи C–Н пространственно более доступны для атаки другими частицами, чем менее прочные связи C–C. В определенных условиях происходит разрыв именно С–Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов.
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Продукты реакции называют галогеналканами или галогенопроизводными алканов.
Условия проведения радикальных реакций:
– повышенная температура (часто реакцию проводят в газовой фазе),
– действие света или радиоактивного излучения,
– присутствие соединений – источников свободных радикалов (инициаторов), неполярные растворители.
Время "жизни" свободных радикалов меньше, чем органических ионов. Например, радикал метил ·СН3 в свободном виде может существовать только 0,003 с. Но именно такие радикалы имеют наибольшее значение в органической химии. С их участием протекают многочисленные реакции – галогенирование, нитрование, сульфохлорирование, а также процессы горения, пиролиза, взрыва, полимеризации, деструкции и др. Эти реакции получили название цепных (радикальных). Их открытие было одним из выдающихся событий в химии. Огромный вклад в изучение цепных реакций и создание их теории сделали академик Н. Н. Семенов (1896–1986) и английский ученый С. Хиншелвуд. Они были удостоены за это высшей научной награды – Нобелевской премии.
Хлорирование метана:
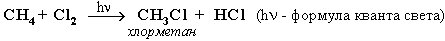
При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
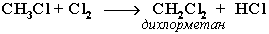
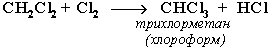
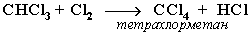
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Механизм радикального замещения (символ SR) на примере монохлорирования метана
Стадия 1 – зарождение цепи – появление в зоне реакции свободных радикалов. Под действием световой энергии гомолитически разрушается связь в молекуле Cl:Cl на два атома хлора с неспаренными электронами (свободные радикалы) ·Cl:
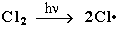
Стадия 2 – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают цепь превращений:
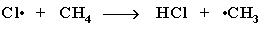
(Реакция Cl· + CH4 à CH3Cl + H· не идет, т.к. энергия атомарного водорода H·значительно выше, чем метильного радикала ·СН3).
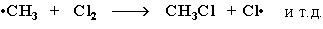
Стадия 3 – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
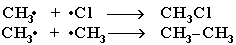
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного.
Стрет.– Н > Свтор.– Н > Cперв.– Н
Это объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по сравнению с первичными вследствие делокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
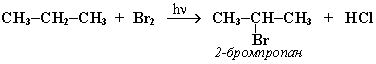
Нуклеофильное замещение SN1 и SN2 реакции
Основополагающий вклад в изучение реакций замещения у sp3-гибридизованного атома углерода внес Ингольд.
Классическим примером реакции нуклеофильного замещения является превращение алкилгалогенида в спирт:
R–Cl + HO– → R–OH + Cl–
При изучении кинетики реакций такого типа было установлено, что они могут протекать по двум механизмам (мономолекулярное и бимолекулярное замещение), которым отвечают кинетические зависимости:
V1=k’[R–Hal] (SN1)
V2= k[R–Hal][HO– ] (SN2)
Обозначение реакций (SN1) и (SN2) было также предложено Ингольдом и расшифровывается, соответственно, как нуклеофильное замещение мономолекулярное и бимолекулярное (от англ. Substitution nucleophilic).
Пример реакции SN1 – гидролиз 2-метил-2-хлорпропана (триметилхлорметана, трет-бутилхлорида)
Общая схема реакции:
(CH3)3CCl + H2O à (CH3)3C–OH + HCl
Стадии процесса:
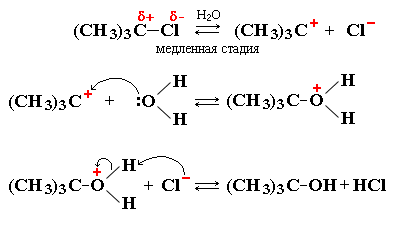
Органические катионы и анионы – неустойчивые промежуточные частицы. В отличие от неорганических ионов, постоянно присутствующих в водных растворах и расплавах, они возникают только в момент реакции и сразу же вступают в дальнейшие превращения.
Предполагается, что реакция SN2 протекает по следующей схеме:
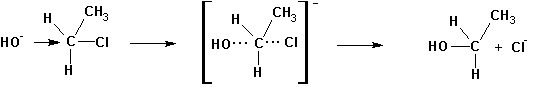
Если в исходном соединении существовала какая-нибудь оптическая конфигурация (D–, L– ), то в результате реакции происходит ее обращение (L–, D–).
В реакции этого типа преимущественно вступают пространственно незатрудненные первичные алкилгалогениды, при отщеплении уходящей группы от которых не образуется стабилизированного карбкатиона.
Условия ионных реакций:
– невысокая температура;
– полярные растворители, способные к сольватации образующихся ионов.
Действие света или радиоактивного излучения не влияет на скорость ионных реакций.
Таблица 1
Влияние различных факторов на реакции нуклеофильного замещения у насыщенного атома углерода
| Факторы | SN1 | SN2 |
| Строение субстрата | Реакционная способность падает в ряду: Бензильный, аллильный > третичный > вторичный > первичный | Реакционная способность растет в ряду: Бензильный, аллильный < третичный < вторичный < первичный |
| Вступающая группа | Практически нет влияния | Чем больше нуклеофильность, тем вероятнее протекание реакции |
| Уходящая группа | Чем ниже энергия связи, тем легче протекает реакция | Замещение затрудняется с увеличением нуклеофильности (основности) уходящей группы |
| Стерические факторы | Увеличение числа алкильных заместителей и электронодонорных групп у нуклеофильного центра способствует протеканию реакции | Препятствуют атаке нуклеофильного центра и затрудняют реакцию |
| Влияние растворителя | Реакции способствуют протонные полярные растворители | Влияние растворителя сказывается значительно меньше, но реакцию затрудняют растворители, сольватирующие нуклеофил. В целом, лучше протекают с апротонными полярными растворителя. |
Реакции элиминирования являются конкурентно протекающими с реакциями нуклеофильного замещения у насыщенного атома углерода SN1 и SN2. Направление реакции в сторону Е1 или Е2 зависит от ряда факторов:
–структура субстрата;
–структура атакующего нуклеофила;
–основность атакующей частицы;
–природа растворителя.
реакции элиминирования Е1 и Е2
Мономолекулярное элиминирование Е1.
Схема реакции совпадает со схемой мономолекулярного замещения до момента образования карбониевого катиона, т.е. отсоединения уходящей группы:
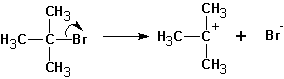
Далее протекает либо реакция замещения, либо (в зависимости от среды и атакующей частицы) отщепление протона и образование продукта элиминирования:
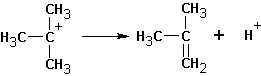
Если существует возможность образования нескольких алкенов, то преимущественно образуются наиболее замещенные алкены. Однако, такая ситуация наблюдается тогда, когда максимально замещенный алкен не имеет пространственных затруднений, как у ниже приведенного (I):
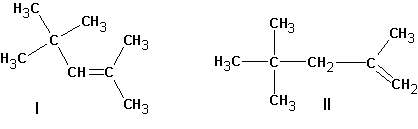
В этом случае предпочтительно образование алкена (II).
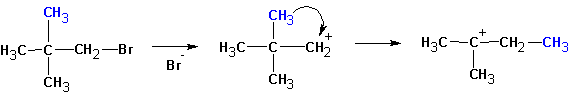
Особенностями реакций SN1 и Е1 является тенденция к перегруппировке образовавшегося карбкатиона:
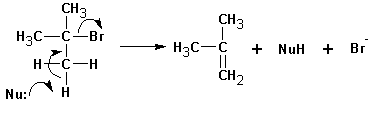
Бимолекулярное элиминирование Е2.
Механизм реакции общих этапов с реакцией SN2 не имеет. Обычно протекает транс- элиминирование по схеме:
Влияние структурных факторов.
Для органических галогенидов с заданным R скорость отщепления меняется в зависимости от уходящей группы (Х) в следующем порядке:
J > Br > Cl > F. При фиксированном Х скорость отщепления следует порядку: третичный R > вторичный R > первичный R. Пространственные препятствия оказывают на реакции Е2 очень слабое влияние по сравнению с реакциями SN2. Отщепление в случае третичных галогенидов происходит очень легко.
Влияние атакующей частицы.
Для проведения Е2 реакций обычно требуются сравнительно сильные основания. В ряду оснований эффективность изменяется параллельно их силе: H2N– > C2H5O– > HO– > CH3COO–. Соответственно, протеканию нуклеофильного замещения способствуют слабоосновные реагенты, подобные иодид- или ацетат-ионам. Отщепление также преобладает над замещением при повышенных температурах. В случае алкилгалогенидов с различными алкильными остатками существует возможность образования двух алкенов:
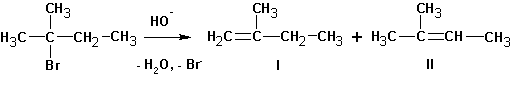
Для большинства реакций отщепления типа Е2 характерно образование наиболее замещенного алкена типа II. Однако в том случае, когда уходящая группа имеет большой объем или обладает сильными электроноакцепторными свойствами, а также если атакующее основание имеет большой объем, может оказаться более благоприятным образование наименее стабильного (наименее замещенного) алкена – Правило Зайцева.
Дата добавления: 2016-11-04; просмотров: 8306;











