Электрофильное замещение.
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Делокализация шести p-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов. Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Наличие областей повышенной p-электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электрофильного замещения.
Рассмотрим механизм электрофильного замещения на примере нитрования бензола.
Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот):
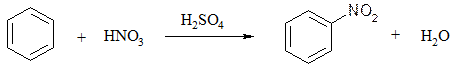
нитробензол
Реакции замещения в кольцо протекают только через образование положительно заряженных промежуточных частиц.
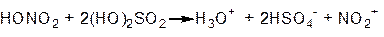
p-комплекс 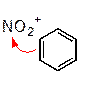
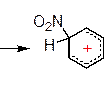 s-комплекс
s-комплекс
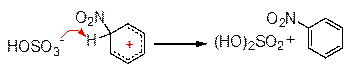
Замещаемой частицей является протон.
По такому механизму протекают реакции алкилирования, галогенирования, сульфирования, нитрования ароматических соединений и другие, различаясь лишь способом образования активной частицы реакции – электрофила Е+
а) сульфирование:
HO–SO3H + H–SO4H à HSO3+ + HSO4–
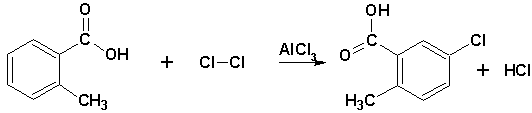
б) галогенирование
Cl2 + AlCl3 à Cl+ + AlCl4–
в) алкилирование:
CH3–CH2–Cl + AlCl3 à CH3–CH2+ + AlCl4–
г) ацилирование
СН3СOCl + AlCl3 à СН3С+=O + AlCl4–
В незамещенном кольце бензола все 6 положений равноценны для вхождения замещающей группы. Сложнее обстоит дело, если в реацию вступают гомологи или производные бензола. В этом случае вновь входящая группа вступает в определенное место в кольце. Это место зависит от уже имеющегося (или имеющихся) в кольце заместителя. Например, если в кольце имеется электронодонорная группировка типа: алкил–, –ОН, –ОСН3, –NH2, –NHR, NR2, –NH–COR, –Х (галоген)(заместители первого рода), то замещающая группа вступает в орто- или пара- положения относительно имеющейся группы:
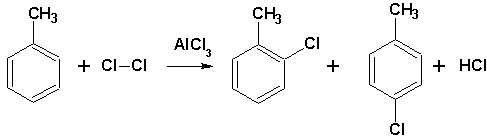
Если в кольце уже имеется электроноакцепторная группировка типа: –NO2, –NO, –SO3H, –CX3, –COOH, –COH, –COR, –CN (заместители второго рода), то вновь вступающая группа становится в мета- положение к ним:
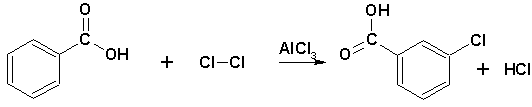
Таблица 2
Сводная таблица заместителей и их электронных эффектов
| Заместитель или группа атомов | Ориентация | Эффекты |
| СН3 > CH3–CH2 > (CH3)2CH | о-, п- ориентация, (галогены–дезактивирующие) | + I, +M |
| (CH3)3C | + I, M=0 | |
| Атом, присоединенный к p–системе, имеет неподеленную пару электронов: X– (галоген), –O–, –OH, –OR, –NH2, –NHR, –NR2, –SH, –SR, | – I, + M | |
| присоединенный к p–системе атом в свою очередь связан с более электроотрицательным атомом: –N=O,–NO2, –SO3H, –COOH, –COH, –C(O)–R, –COOR, –CN, –CX3, –C=N=S, | м-ориентация, с дезактивированием | – I, –M |
| sp2-гибридизованный углерод: –СН=СН–, –С6Н5 (фенил) | о-, п- ориентация | I=0,+M |
| Атом, не имеющий р–орбиталей, но с полным положительным зарядом –NH3+, –NR3+ , | м- ориентация, с дезактивированием | –I, M=0 |
Если в кольце имеется два заместителя разного рода, направляющие замещение несогласованно, то место вступления новой группы определяется по заместителю первого рода, например:
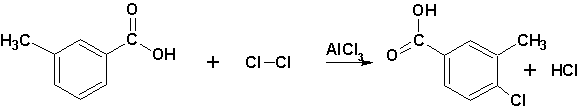
В следующем случае наблюдается согласованная ориентация.
Дата добавления: 2016-11-04; просмотров: 2036;











