Свободнорадикальное (перекисное) окисление мембран и их антиоксидантная защита.
Важным механизмом повреждения клеточных мембран является свободнорадикальное (перекисное) окисление. Этот универсальный механизм повреждения встречается в патогенезе гепатитов, инфаркта миокарда, панкреатита и других болезней. В норме умеренное образование свободных радикалов (активные формы кислорода, перекись водорода и другие вещества с незавершенным внешним электронным слоем) постоянно происходит в клетке. Свободные радикалы постоянно атакуют мембраны клеток (особенно "хвосты" фосфолипидов), что может нарушить их структуру и функции. Этому успешно противостоят антиоксидантные системы: экзогенная (препараты селена, витамины Е, С) и эндогенная (ферменты каталаза, супероксиддисмутаза, убихинон).
При интенсификации образования свободных радикалов под влиянием повреждающих факторов болезни (вирусы, радиация) происходит резкое увеличение перекисного окисления липидов (ПОЛ) мембран и нарушение их функций.
Поиск эффективных антиоксидантов ведет к созданию новых действенных препаратов для лечения заболеваний, которые сопровождаются интенсификацией ПОЛ.
Клетка представляет собой сложную структуру, состоящую из разнообразных органоидов и клеточных жидкостей (цитозоль, гиалоплазма, кариоплазма…). По строению и наличию клеток все живые организмы делят на 3 группы: прокариоты, эукариоты, вирусы.
Прокариоты – безъядерные клетки. Основные представители прокариотов бактерии, сине-зеленые водоросли.
Эукариоты – клетки содержащие ядра. Основные представители эукариотов: животные, растения, грибы.
Вирусы (в т.ч. бактериофаги) не имеют клеточного строения, но они не проявляют признаков жизни вне контакта с клетками прокариотов и эукариотов. По этой причине предположение клеточной теории Шванна и Шлейдена о невозможности жизни вне клеток не потеряло своей актуальности и после открытия вирусов.
Методические указания для самоподготовки к занятию № 3.
Тема. Мембраны и органоиды клетки. Клеточная теория.
Цель самоподготовки. Расширить и закрепить представления по вопросам темы.
Вопросы для самостоятельного изучения задания.
1. Современные представления о составе липидов мембран клетки.
2. Влияние состава мембран на их свойства.
3. Лабильность и стабильность липидного бислоя.
4. Липосомы и мицеллы.
5. Значение знаний о составе липидов мембран клетки. Примеры из фармакологии и токсикологии.
Блок дополнительной информации.
Мембранные липиды.
Рис. 1. Схема строения клеточной мембраны.
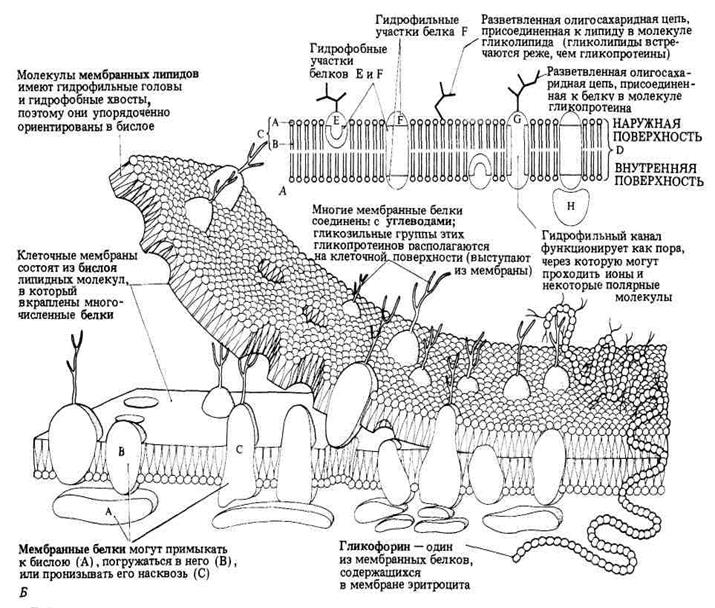
Всостав мембран входят липиды следующих классов:
1 - фосфолипиды (ФЛ),
2- сфинголипиды (СЛ),
3- гликолипиды (ГЛ),
4- стероиды, а именно холестерин (ХС).
Рис.2. Классы мембранных липидов
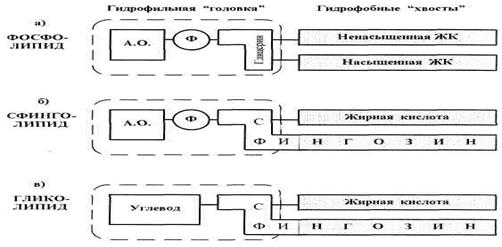
Именно липиды первых трех перечисленных классов имеют то характерное строение (гидрофильная «головка» и два гидрофобных «хвоста»), которое показано в общем виде на рис. 1.
У фосфолипидов (ФС)(рис. 2а) в состав «головки» обычно входят последовательно связанные друг с другом остатки азотсодержащего основания (холина, коламина или серина), фосфатной группы и трехатомного спирта глицерина. Всё это полярные группировки (поскольку содержат много гетероатомов), и потому они являются гидрофильными. Остатки же жирных кислот (ЖК), образующие гидрофобные «хвосты», соединены с глицерином. В качестве насыщенной кислоты часто выступает пальмитиновая кислота, а в качестве ненасыщенной — олеиновая кислота. В месте нахождения двойной связи углеводородная цепь делает изгиб на 40°. Поэтому, несмотря на различие С- атомов в олеиновой и пальмитиновой кислотах, длина обоих «хвостов» оказывается практически одинаковой. Это облегчает образование двойного слоя (бислоя).
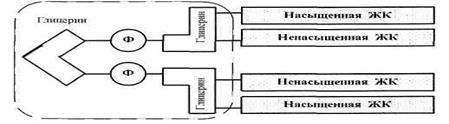
В мембранах имеются и такие ФЛ, чья структура несколько отличается от схемы, приведенной на рис. 2а. Например, кардиолипины (рис. 3) — это две фосфатидные кислоты, связанные друг с другом через глицерин. Соответственно, в этих молекулах — 4 углеводородных «хвоста» и более объемная, чем обычно, гидрофильная «головка».
Рис. 3. Схема кардиолипина.
Сфинголипиды(СЛ, рис. 2б), по сравнению с ФЛ, состоит в том, что вместо глицерина и одной из жирных кислот они включают сфингозин (он же сфингенин) — двухатомный аминоспирт, содержащий 18 С-атомов и 1 двойную связь. Поэтому начальная часть сфингозина входит в гидрофильную «головку» СЛ, а последующая углеводородная цепь служит одним из гидрофобных «хвостов».
Типичный представитель СЛ — сфингомиелин,где в качестве азотсодержащего основания выступает холин.
Гликолипиды(ГЛ, рис. 2в) тоже содержат остаток сфингозина. Но в состав гидрофильной «головки» вместо азотсодержащего основания и фосфатной группы входит какой-либо углевод (У). По природе последнего ГЛ подразделяются на две группы: цереброзиды(здесь У — галактоза или глюкоза) и ганглиозиды (У — олигосахарид, причем обычно разветвленный). В качестве же ЖК гликолипиды часто содержат особые кислоты — нервоновуюили цереброновую.Так, первая из них содержит 24 С-атома и 1 двойную связь (С24Л).
Несколько особняком стоит структура четвертого класса мембранных липидов — стероидов, точнее, их основного представителя — холестерина(ХС). Он (рис. 4.), как известно, представляет собой вытянутую систему четырех углеводородных циклов и углеводородную же боковую цепь. За исключением одной гидроксигруппы, ХС — гидрофобноесоединение.
Рис. 4. Холестерин в структуре мембраны.
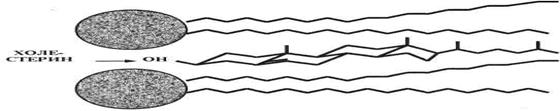
В силу своей гидрофобности, в мембране ХС находится, в основном, в срединной зоне бислоя, и лишь гидроксигруппа примыкает к «головкам» липидов. При этом вытянутые молекулы ХС ориентированы параллельно углеводородным цепям указанных липидов.
Каждый вид мембран отличается строго определенным содержанием вышеперечисленных классов липидов. И это во многом определяет свойства данных мембран.
Отношение белок/липиды в среднем близко к 1:1, но в ряде случаев оно значительно отклоняется от этого уровня. Миелиновые оболочки сильно обогащены липидами, а внутренняя мембрана митохондрий — белками.
Внешние мембраны значительно богаче внутренних по содержанию таких компонентов, как углеводы, сфинго- и гликолипиды, холестерин.
ГЛ и ХС условно называют «стабилизирующие». Во внутренних мембранах таких липидов почти нет, т. е. соотношение сильно сдвинуто в сторону «дестабилизирующих» липидов — в основном ФЛ.
ВлияниеФЛ и СЛ. Эти липиды, как мы знаем, включают непредельные углеводородные «хвосты». Причем среди них встречаются остатки не только олеиновой кислоты, но и полиненасыщенныхкислот — линолевой, линоленовой, арахидоновой и других. Но, известно, в каждом месте нахождения двойной связи углеводородная цепь имеет изгиб. А изгибы затрудняют взаимодействие соседних цепей, что делает структуру бислоя менее упорядоченной. Поэтому по мере увеличения содержания в мембране ФЛ и СЛ возрастают все показатели ее лабильности: повышается латеральная диффузиякомпонентов мембраны (из-за уменьшения взаимодействия между молекулами); увеличивается диффузиясоответствующих веществ (например, неполярных соединений) через мембрану (т.к. возрастают промежутки между «хвостами» липидов); повышается способностьмембран к разрыву. Все это и объясняет, почему ФЛ и СЛ называют «дестабилизирующие» липиды.
Влияние ХС и ГЛ.Данные же липиды оказывают на лабильность мембраны два противоположных действия. С одной стороны, они вносят дезорганизацию в расположение углеводородных «хвостов»: ХС — за счет внедрения между последними, а ГЛ — из-за более длинных, чем обычно, остатков нервоновой и цереброновой кислот. Это несколько дестабилизирует мембраны. Но, с другой стороны, те же факторы (наличие ХС между липидами и длинные «хвосты» ГЛ, почти лишенные двойных связей) препятствуют активному перемещению липидов. А это, напротив, оказывает стабилизирующее действие, которое в итоге и перевешивает. По данной причине ХС и ГЛ отнесены к разряду «стабилизирующих» мембранных липидов.
Поскольку во внутренних мембранах клеток этих липидов (ХС и ГЛ) очень мало, можно сделать вывод: данные мембраны более лабильны, чем внешние. Т. е. они более текучи (выше латеральная диффузия), более проницаемы и более склонны к разрыву. Все эти свойства могут меняться со временем и для одной и той же мембраны. Причиной этому обычно служит изменение ее липидного состава. Пример — мембраны сперматозоида. В них высоко содержание ФЛ с большим количеством двойных связей в «хвостах». Это, значительно лабилизирует (делает подвижными, текучими) мембраны. Кроме того, в женских половых путях секретируется белок, нагруженный ФЛ. Эти ФЛ с данного белка переходят в состав мембран сперматозоидов в обмен на ХС. Таким образом, соотношение между «дестабилизирующими» и «стабилизирующими» липидами еще больше сдвигается в пользу первых. Поэтому лабильность мембран сперматозоидов, уже и так высокая, достигает критического предела. Мембраны головок сперматозоидов - "камикадзе" легко разрываются при контакте с оболочками яйцеклетки, обеспечивая, их растворение и подготавливая оплодотворение.
Кроме лабильности, от липидного состава зависят и другие свойства мембран.
Дата добавления: 2016-10-18; просмотров: 2519;











