ХИМИЗМ ПОЛУЧЕНИЯ ГРЕМУЧЕЙ РТУТИ
Гремучая ртуть получается действием азотнокислого раствора ртути на этиловый алкоголь. Реакция образования гремучей ртути настолько своеобразна и протекает столь бурно и быстро, что исследователи долгое время (более 100 лет) не могли познать ее истинного хода,так как не удавалось установить ни одной промежуточной стадии этого процесса. Шишков первым попытался показать механизм образования гремучей ртути. Однако ни эта попытка, ни последовавшие затем попытки Голлемана, Шолля и Штейнера не привели к положительным результатам. Лишь после того, когда был обнаружен распад метилнитриловой кислоты на гремучую и азотистую кислоты, а также после обнаружения, что для реакции пригоден именно этиловый спирт, а не метиловый, и что ацетальдегид даст при реакции гремучую ртуть легче, чем этиловый спирт, — были найдены основные звенья и появилась возможность объяснить ход процесса образования гремучей ртути. В 1909 г. Виланд на основании своих многочисленных работ объяснил весь сложный процесс реакции но отдельным стадиям. Ход реакций представляется ныне в следующем виде:
1. Вначале происходит окисление этилового алкоголя в ацетальдегид (его запах всегда чувствуется при получении гремучей ртути):
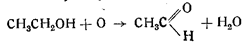
2. Далее идет реакция нитрозирования ацетальдегида в изони-трозоацетальдегид:
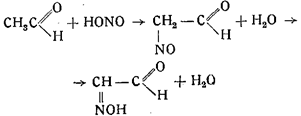
Кстати, существование этих двух фаз реакции предполагал несколько ранее и Велер.
3. Затем происходит окисление изонитрозоацетальдегида в изони-трозоуксусную кислоту:
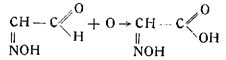
4. Изонитрозоуксусная кислота нитруется азотной кислотой в нитроизонитрозоуксусную кислоту:
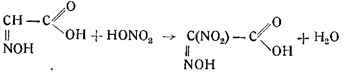
5. Нитроизонитрозоуксусная кислота — соединение весьма нестойкое и переходит с выделением углекислоты в метилнитроловую кислоту;
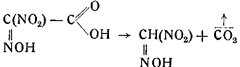
6. Метилнитроловая кислота диссоциирует на гремучую кислоту и азотистую кислоту:
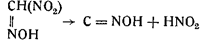
Если последнюю фазу вести в присутствии ртутной или серебряной азотнокислых солей, то вместо легко разлагающейся гремучей кислоты образуется стойкая гремучая ртуть или гремучее серебро:
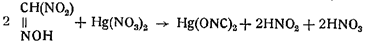
По этой схеме азотистая кислота оказывается весьма активным агентом в процессе образования фульмината. Образуется же она во время реакции (фазы I и III) непрерывно из имеющейся в избытке азотной кислоты. Необходимость присутствия азотистой кислоты (теоретически даже в незначительных количествах), для того чтобы вызвать реакцию, подтверждается тем, что прокипяченная азотная кислота, свободная от окислов азота, ни со спиртом, ни с уксусным альдегидом гремучей кислоты не образует. Это положение в свое время высказывали еще Зельми, Собреро и Жерар, а опыты Велера иТеодоровича его окончательно подтвердилиРеакция образования гремучей ртути протекает весьма бурно с выделением тепла, вполне достаточного для разогрева и кипения спирта и азотной кислоты. Выделение кристаллов гремучей ртути сопровождается выбрасыванием густых, белых взрывчатых паров, состоящих, главным образом, из этилнитрита и этилнитрата с примесью большого количества ацетальдегида и угольной кислоты. Кроме того, выделяются глиоксаль, глиоксалевая кислота, щавелевая кислота и другие продукты окисления спирта.
Главнейшие побочные реакции следующие:
1) образование этилнитрита:
CH3CH2OH + HONO = CH3CH2ONO + H2O
2) образование этилнитрата:
СН3СН2ОН + HONO2 = СНзСН2ОNO2+Н2О
3) образование щавелевой кислоты:
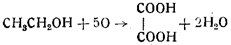
4) образование муравьиной кислоты:
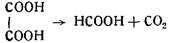
5) образование этилового эфира муравьиной кислоты:
НСООН+С2Н5ОН = НСООС2H5+Н2О
6) образование окиси углерода:
HCOOH = CO + H2O
и др.
Для получения гремучей ртути пользуются в лабораториях и в технике старым способом, установленным еще Либихом и лишь несколько измененным другими исследователями.
По Либиху, 1 в. ч. металлической ртути растворяют в 12 в. ч. азотной кислоты уд. веса 1,36—1,40. Затем в два приема к раствору приливают 11—12 в. ч. обыкновенного спирта. Вторую половину спирта приливают постепенно только после начала кипения раствора.
В 1886 г. Бекман несколько изменил способ Либиха. Он предложил растворять 50 г (1 в. ч.) металлической ртути в 600 г (12 в. ч.) азотной кислоты уд. веса 1,40 и приливать 550 г (11 в. ч.) спирта крепостью 98,5% также в два приема. Спирт и раствор ртути в азотной кислоте он рекомендовал подогревать до температуры 25—30°. Вторую половину спирта Бекман постепенно вводил после перехода
цвета раствора из светложелтого в красноватый, Лобри де-Брюен не без основания находит способы Либиха и Бекмана довольно опасными, так как после приливания первой половины спирта происходит очень бурная реакция с выделением бурых паров (окислы азота). Вследствие этого смесь может разбрызгиваться, а температура поднимается настолько высоко, что если во-время не подливать второй половины спирта, может получиться взрыв.
Лобри де-Брюен рекомендует приливать раствор ртути к спирту, а не наоборот. В этом случае реакция идет спокойнее, и можно вести ее с 300—400 г металлической ртути сразу. Он также расходовал на 1 в. ч. металлической ртути 12 в. ч. азотной кислоты (уд. веса 1,34). Раствор ртути он нагревал до 70° и приливал его к 10 в. ч. 90%-ного спирта.
Шанделон предлагает следующий режим: 1 в. ч. металлической ртути растворить в 10 в. ч. азотной кислоты (уд- вес 1,4). Раствор нагреть до 54° и выливать тонкой струёй в 8,3 в. ч. 91%-ного -спирта.
Кроме этих способов получения металлических производных гремучей кислоты из спирта и азотной кислоты следует отметить уже описанные нами выше синтезы Нефа (из нитрометаннатрия) и Шолля из формилхлоридоксима под действием азотнокислой ртути). Следуя методу Нефа, Джонс получил количественно гремучую ртуть, действуя разбавленной соляной кислотой на основную ртутную соль нитрометана, а Биддль показал, что хлорид ацетилформилоксима при длительном стоянии в водном растворе азотнокислого серебра превращается в гремучее серебро, хлористое серебро и уксусную кислоту:
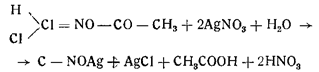
В 1901 г. Ф. Анжелико доказал, что можно очень легко получить гремучую ртуть из малоновой кислоты, если к раствору ртути в разбавленной азотной кислоте приливать концентрированный водный раствор малоновой кислоты и несколько капель азотистонатриевой соли. Осаждается гремучая ртуть при бурном выделении двуокиси углерода и повышении температуры. Анжелико объясняет эту реакцию тем, что из малоновой кислоты СН2(СООН)2 получается вначале изонитрозомалоновая кислота С(NОН)(СООН)2, которая переходит в изонитромалоновую C(NOOH)(COOH)2, а последняя, отщепляя угольный ангидрид, дает изонитроуксусную кислоту CH(NOOH)(COOH), которая, выделяя вторую молекулу угольного ангидрида, образует изонитрометан CH2=NООН и далее гремучую кислоту.
Однако Г. Понцио указывает, что этот процесс протекает иначе, а именно, через изонитрозомалоновую кислоту, изонитроуксусную кислоту и метилнитроловую кислоту:
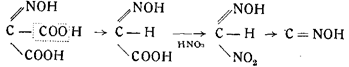
Следует привести также предложенный Г. Виландом способ, основанный на разложении амидометилнитрозоловой кислоты. Схема получения самой кислоты следующая:
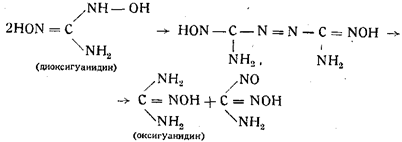
Метиловый спирт с азотной кислотой не образует гремучей кислоты. Это было замечено еще Дюма и Пелиготом, а затем Шталь-шмидтом, получившим, кстати сказать, гремучую ртуть из лигнона. Все попытки многих исследователей получить гремучую ртуть из монокарбоновых соединений не привели к цели.
Велер и Теодорович показали, что можно получить гремучую ртуть окислением азотной кислотой целого ряда органических веществ, содержащих метильную группу — СНц в соединении с одной из следующих четырех групп:
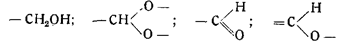
в присутствии окислов азота и азотнокислой ртути. Им удалось получить гремучую ртуть из диметилацеталя, из лигнона, содержащего кроме диметилацеталя метиловый спирт, метилацетат и ацетон, а также из диэтилацеталя, ацетальдегида, паральдегида и метальдегида.
Следует, конечно, отметить, что все новые синтетические методы, предлагавшиеся Нефом, Велером, Виландом и др., очень дороги или дают малый выход продукта.
Дата добавления: 2021-02-19; просмотров: 1165;











