ПРИМЕСИ ГРЕМУЧЕЙ РТУТИ
Гремучая ртуть может образоваться в двух модификациях: белой и серой. Вопрос о разнице в цвете долгое время оставался и остается еще до сих пор спорным. По этому вопросу существуют различные точки зрения.
Каст пишет на основании не из отдельных кристаллов, а из сросшихся в продольном своих исследований: «Так называемая «серая» гремучая ртуть, приготовленная без добавления соляной кислоты, имеет слабокоричневую окраску и состоит из правильно образовавшихся прозрачных и светлых кристаллов. Углы, образуемые двумя смежными ребрами кристалла, были измерены Риттером в 126° и 53,5°. Поэтому кристаллы относятся К моноклинической системе. Продукт считается весьма чистым, если он содержит 99,7—99,9% растворимой в соляной кислоте ртутной соли и растворяется в водном аммиаке со слабым помутнением. Нерастворимый в соляной кислоте остаток на фильтре окрашивается аммиаком в весьма слабый серый цвет и состоит, вероятно, из хлористой ртути от некондиционных сырых материалов».
«Так называемый белый продукт имеет почти чисто белый цвет с весьма слабым серым оттенком и состоит направлении кристаллических систем. Вследствие своего сращивания кристаллы непрозрачны и очень сильно отражают свет, почему они и кажутся белыми. Продукт менее чист, чем серый, содержит 99,3—99,4% растворимых в соляной кислоте солей ртути и растворяется в водном аммиаке с образованием темного осадка. Нерастворимый в соляной кислоте остаток (0,6—0,7%) на фильтре с аммиаком окрашивается в немного более темный цвет, чем осадок серой гремучей ртути».
Таким образом Каст считает, что различная окраска гремучей ртути зависит, главным образом, от физических причин, т. е. объясняется более или менее сильным преломлением света, с одной стороны, и величиной кристаллов, с другой.
Такое объяснение цветности гремучей ртути не выдерживает критики, тем более, что разница в величине кристаллов белой и серой гремучей ртути невелика и что даже путем перекристаллизации из аммиака можно получить еще большие кристаллы совершенно белого цвета. Лучепреломление кристаллов белого и серого цвета, как установил Вертман, одинаково.
Другие исследователи объясняют причину серого цвета примесями, но и здесь отсутствует единое мнение, так как даже вопрос о количестве примесей еще является спорным. О том, что белая гремучая ртуть загрязнена более, чем серая, наряду с Кастом указывает в своих исследованиях и Филипп. Однако микроскопические исследования кристаллов гремучей ртути показывают, что такое утверждение неверно: чистота того и другого продукта примерно одинакова.
Часть исследователей (И. Чельцов, Бертло и Вьель, Велер и др.) видят причину образования серой гремучей ртути в наличии примеси металлической ртути, которая в коллоидальном состоянии пронизывает кристаллы и легко распознается под микроскопом, особенно если гремучую ртуть ввести в бензол или в канадский бальзам, так как тогда кристаллы становятся прозрачными с высоким показателем преломления. Точно так же при растворении гремучей ртути в тиосульфате натрия остаются нерастворимыми шарики металлической ртути.
Это показывает следующая таблица, составленная по опытам Солонина, Велера и Теодоровича.
| Примеси | Цвет гремучей ртути | ||
| к спирту | к азотнокислому раствору ртути | ||
| 1. | CuCl2 – 0.8 г | -- | Белый |
| 2. | Cu2Cl2 – 1 г | -- | Белый с незначительным сероватым оттенком |
| 3. | Cu2Cl2 – 1.5 г | -- | Белый |
| 4. | Cu2Cl2 – 2 г | -- | Белый |
| 5. | -- | Cu2Cl2 – 0.8 г | Белый |
| 6. | -- | Cu2Cl2 – 1.3 г | Светлее, чем в опыте 15 (без примесей) |
| 7. | Cu(NO3)2 – 3.8 г | -- | Цвет как без добавки в опыте 15 |
| 8. | CuSO4 × 5H2O – 5 г | -- | Темнее, чем в опыте 15 |
| 9. | -- | 0.5 г HCl (15°Be) + 0.5 г Cu | Белый |
| 10. | -- | HCl (15°Be) – 1 мл | Чисто белый |
| 11. | HCl (15°Be) – 1 мл | -- | Чисто белый |
| 12. | HCl (15°Be) – 1 мл | -- | Чисто белый |
| 13. | -- | NaCl – 1 г | Серый, светлее, чем в 15 опыте |
| 14. | -- | BaCl2 × H2O – 1 г | Белый, как в опыте 2 |
| 15. | Без примесей | Серый |
Примечание. Опыты производились со следующей рецептурой: металлической ртути .......... 50 г
азотной кислоты (d=1,38) ...... 450 »
спирта (96%-ного) ........... 500 »
Если тщательно присмотреться к условиям реакции, то можно заметить, что серая гремучая ртуть с содержанием металлической ртути получается в том случае, если процесс ее изготовления был ненормален. Если реакция образования протекает слишком медленно вследствие большой теплоотдачи или применения холодных исходных материалов, то получается серая гремучая ртуть с содержанием металлической ртути. Объяснять цветность, базируясь на испытаниях такой гремучей ртути, конечно, нельзя. Если же процесс образования гремучей ртути протекает достаточно бурно, то образующийся серый продукт всегда свободен от металлической ртути.
Пробой на амальгамирование золотой пластинки можно установить даже в так называемой чистой гремучей ртути независимо от ее цветности наличие следов ртути. Однако это, как увидим ниже, не металлическая ртуть, а ртутные соединения, отличные от гремучей ртути.
Опыт показывает, что можно получить как серую, так и белую гремучую ртуть с одним и тем же содержанием металлической ртути.
Больше того, можно получить серую гремучую ртуть и с меньшим содержанием металлической ртути. Следовательно, наличие металлической ртути не является причиной окраски гремучей ртути.
Другая часть исследователей утверждает, что в процессе получения гремучей ртути образуется много распыленных органических примесей, которые, попадая в кристаллы гремучей ртути, придают ей серый цвет. При введении же даже ничтожного количества связанного хлора (на 400 г металлической ртути 5 мл НС1 и 5 г меди или соответствующее количество полухлористой меди) гремучая ртуть получается белой. Его действие сводится, видимо, к отбеливанию этих органических примесей.
Даней показал, что белая гремучая ртуть может быть получена в присутствии малых количеств других медных солей и при полном отсутствии галоидов. Так, при прибавлении при 50° к смеси, состоящей из 25 ч. 95°-ного спирта и раствора 2,5 ч. ртути в 25 ч. HNO3 (уд. вес 1,4) и 0,05 ч. меди (в виде нитрата) получается белая гремучая ртуть. Выходы изменяются в зависимости от количества нитрата меди. Приведенная ниже таблица показывает, что вначале выходы остаются постоянными, затем при прибавлении цитрата меди более 0,7 г они уменьшаются; дальнейшее прибавление нитрата, например до 3,5 г, приводит к повышению выхода гремучей ртути, но последняя становится загрязненной оксалатом меди.
| Количество меди в виде нитрата | Выход фульмината, г | Цвет | Содержание фульмината, % |
| 0,00 0,05 0,50 0,65 0,70 0,75 0,80 2,00 3,50 | 3,05 3,00 3,03 3,06 2,98 2,60 2,55 2,70 3,40 | Серый Белый Белый Белый Белый Белый Белый Белый Белый, загрязненный оксалатом меди | 98 – 98,8 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 98,4 – 99,5 |
При замене нитрата меди нитратами никеля, цинка или кобальта получается не чисто белый продукт, а более или менее темный.
Предполагают, что медь не образует промежуточного соединения в виде фульмината меди, а только участвует в предшествующей стадии образования гремучей кислоты, В самом деле, если подействовать 0,4 г фульмината меди на 1 г ртути, растворенной в минимальном количестве азотной кислоты, то получается 0,074 г серой нечистой (93%-ной) гремучей ртути.
Повидимому, наиболее верным является широко распространенный взгляд, что серая окраска получается вследствие частичного образования смолистых полимеризованных продуктов бурого цвета, похожих на азульмовую кислоту. В пользу этого говорит и то, что условия реакции вполне подходящи для осмоления-Например, раствор 5 г азотнокислой ртути в 25 мл азотной кислоты (уд. веса 1,4) окрашивается в бурый цвет при нагревании до 70—80° с 20 мл ацетальдегида, а через некоторое время на стенках сосуда оседает бурое смолистое вещество.
Продукты осмоления также образуются в процессе получения гремучей ртути из ацетальдегида или изонитрозоацетальдегида, являющихся, как известно, промежуточными продуктами.
Кроме этих продуктов полимеризации и металлической ртути в технической гремучей ртути находятся и другие примеси. Если на гремучую ртуть подействовать цианистым калием, аммиаком или пиридином, то главная масса перейдет в раствор и при этом всегда останется темный остаток, содержащий ртуть. Нельзя, однако, утверждать, что этот остаток состоит только из металлической ртути. Качественные исследования, произведенные А. А. Солонина, показали, что в нем содержится и азот и углерод. Отсюда следует, что, повидимому, это какое-то непрочное органическое соединение, легко разлагающееся при нагревании с выделением металлической ртути.
Известно также, что аммиак и цианистый калий действуют на закисные соединения ртути с образованием металлической ртути. Хлористая закисная ртуть дает с аммиаком хлористый меркураммоний с выделением металлической ртути:
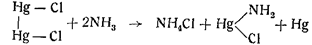
Аммиак при действии на азотнокислую закисную ртуть дает черный осадок меркураммониевой соли и металлической ртути:
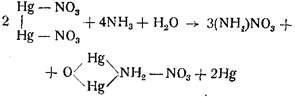
Цианистый калий при действии на закисную азотнокислую ртуть осаждает металлическую ртуть с образованием растворимой цианистой ртути:
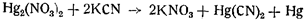
Повидимому, остаток от гремучей ртути после растворения ее в пиридине, аммиаке и цианистом калии является следствием разложения каких-то закисных соединений ртути, являющихся спутниками гремучей ртути.
Если получать гремучую ртуть, пользуясь вместо спирта паральдегидом, то, прежде чем начинают образовываться кристаллы гремучей ртути, возникает осадок бесцветных листочков. Анализ этих листочков, отфильтрованных тотчас после их образования, показал наличие основного нитрата ртути:
Hg4(N03)3OH
Вполне вероятно, что незначительное количество этой основной соли получается и при изготовлении гремучей ртути обычным путем, так как гремучая ртуть всегда содержит следы ионов N0'3.
Если растворить 5 г ртути в 36 мл очищенной от окислов азотной кислоты (уд. веса 1,4) и затем короткое время нагревать при 70° в 50 мл спирта, то образуется соль Купера:
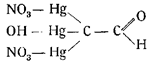
представляющая собой продукт [реакции основного нитрата ртути с ацетальдегидом.
Не исключена возможность наличия и этого соединения в числе примесей гремучей ртути, тем более, что концентрация отдельных компонентов, при которых происходит образование соли Купера, примерно соответствует (за исключением окислов азота) концентрации тех же компонентов при получении гремучей ртути.
Применение для получения белого продукта полухлористой меди или меди и соляной кислоты влечет за собой, конечно, образование, хотя и в незначительном количестве, хлорида окисной ртути.
Дальнейшим источником загрязнений является маточный раствор, остающийся в кристаллах гремучей ртути. Исследования кристаллов под микроскопом в бромбензоле или канадском бальзаме показывают, что внутри кристаллов параллельно краям расположены ряды маленьких пузырьков, в которых находится жидкость. Ратсбург определил потерю в весе гремучей ртути при продолжительном вылеживании. Он в течение полугода нагревал серую и перекристаллизованную из аммиака гремучую ртуть при 50—60° и нашел, что убыль в весе серой гремучей ртути составила 3,7%, а перекристаллизованного продукта — только 0,2%.
Бергман наблюдал процесс растворения гремучей ртути в аммиаке и тиосульфате натрия под микроскопом. В результате он установил, что те места кристаллов, в которых находятся пузырьки раствора, растворяются быстрее.
Наконец, примесью гремучей ртути является также оксалат ртути. Правда, если процесс образования гремучей ртути протекает вполне нормально, то примеси оксалата не будет (об этом см. ниже). Оксалат ртути образуется при неправильно ведомом процессе и в результате долгого стояния готового продукта в маточном растворе.
Побочные и промежуточные. Продукты процесса образования гремучей ртути остаются только в незначительных количествах. Основными примесями являются, невидимому, маточные включения и продукты их взаимодействия с гремучей ртутью в период хранения.
Содержание чистой гремучей ртути, получаемой как в заводских, так и в лабораторных условиях, колеблется в пределах 98—99%.
Наиболее нежелательными примесями гремучей ртути являются следующие:

Рисунок 44 – Белая гремучая ртуть
1) металлическая ртуть и закисные ее соединения, которые, находясь в соприкосновении с медью в снаряженных капсюлях, взаимодействуют с металлом, образуют амальгаму меди и делают металл хрупким;
2) маточные включения (кислотность), которые могут разлагать составы, изготовленные с гремучей ртутью, и разъедать оболочку;
3) случайно попавшие нерастворимые посторонние примеси (песок и т. п.), повышающие чувствительность к внешним воздействиям и вызывающие опасность в обращении с сухой гремучей ртутью при снаряжении.
Дата добавления: 2021-02-19; просмотров: 656;











