Иммобилизованные ферменты
Одна из задач инженерной энзимологии состоит в разработке технологии получения и использования иммобилизованных ферментов. Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства. Начало этому направлению биотехнологии было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность.
В настоящее время в понятие «иммобилизация» вкладывают более широкий смысл – полное или частичное ограничение свободы движения белковых молекул.
Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами:
· представляют собой гетерогенные катализаторы, легко отделяемые от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт;
· могут использоваться многократно и обеспечивают непрерывность каталитического процесса;
· изменяют свои свойства: субстратную специфичность, устойчивость, зависимость активности от параметров среды;
· долговечны в тысячи и десятки тысяч раз стабильнее свободных энзимов.
Все перечисленное обеспечивает высокую экономичность, 

 эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру.
Носители для иммобилизации ферментов. К носителям предъявляются следующие требования:
· высокая химическая и биологическая стойкость;
· высокая химическая прочность;
· достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность;
· возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
· легкая активация;
· высокая гидрофильность;
· невысокая стоимость.
Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей (рис. 7.1).
  НОСИТЕЛИ НОСИТЕЛИ
| |||
  ОРГАНИЧЕСКИЕ ОРГАНИЧЕСКИЕ
|   НЕОРГАНИЧЕСКИЕ НЕОРГАНИЧЕСКИЕ
| ||
| НИЗКОМОЛЕКУЛЯРНЫЕ | ПОЛИМЕРНЫЕ | МАКРОПОРИСТЫЕ | ДРУГИЕ |
Рис. 7.1. Классификация носителей для иммобилизованных ферментов
Органические полимерные носители. Существующие органические полимерные носители можно разделить на два класса: природные (белковые, полисахаридные и липидные) и синтетические полимерные носители (полиметиленовые, полиамидные и полиэфирные).
Преимущества природных носителей: доступность, полифункциональность и гидрофильность; недостатки: биодеградируемость и высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют целлюлозу, декстран, агарозу и их производные. Для придания химической устойчивости линейные цепи целлюлозы и декстрана поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры вводят различные ионогенные группировки. Химической модификацией крахмала сшивающими агентами (формальдегид, глиоксаль, глутаровый альдегид) синтезирован новый носитель – губчатый крахмал, обладающий повышенной устойчивостью к гликозидазам.
Из природных аминосахаридов в качестве носителей применяют хитин. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков в качестве носителей применяют структурные протеины, – кератин, фиброин, коллаген и желатина (продукт переработки коллагена). Белки способны к биодеградации, что очень важно при конструировании иммобилизованных ферментов для медицинских целей. К недостаткам белков как носителей в этом случае следует отнести их высокую иммуногенность.
Синтетические полимерные носители. Большинство синтетических полимерных носителей обладают механической прочностью, и возможностью варьирования в широких пределах величины пор. Некоторые синтетические полимеры могут быть произведены в различных физических формах (трубы, волокна, гранулы). К ним относятся полимеры на основе стирола, акриловой кислоты, поливинилового спирта; полиамидные и полиуретановые полимеры.
Носители неорганической природы. В качестве носителей наиболее часто применяют материалы из стекла, глины, керамики, графитовой сажи, силикагеля, а также силохромы, оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают пленкой оксидов алюминия, титана, циркония или обрабатывают органическими полимерами. Основное преимущество неорганических носителей – легкость регенерации. Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Методы иммобилизации ферментов
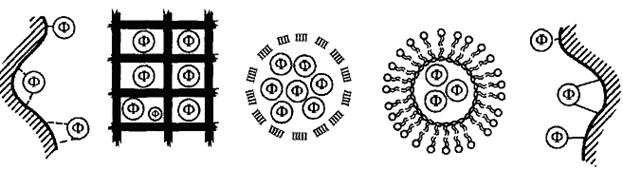
Существуют два принципиально различных метода иммобилизации ферментов: физические (без возникновения ковалентных связей между ферментом и носителем) и химические (с образованием ковалентной связи между ними) (рис. 7.2).
| ||||
| а | б | в | г | д |
| Рис 7.2. Методы иммобилизации ферментов Физические методы иммобилизации: а – адсорбция; б – включение в гель; в – инкапсулирование; г – включение в липосомы; Химические методы иммобилизации: д – ковалентные связывание |
Физические методы иммобилазации представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов.
Адсорбция ферментов на нерастворимых носителях. Адсорбция была первым методом иммобилизации ферментов и стала наиболее широко распространенным способом получения иммобилизованных ферментов в промышленности. В качестве адсорбентов используют кремнезем, активированный уголь, графитовая сажа, различные глины, пористое стекло, полисахариды, синтетические полимеры, оксиды алюминия, титана и других металлов. При адсорбционной иммобилизации белковая молекула удерживается на поверхности носителя за счет электростатических, гидрофобных, дисперсионных взаимодействий и водородных связей. Эффективность адсорбции определяется удельной поверхностью (плотностью центров сорбции) и пористостью носителя.
Процесс адсорбции ферментов на нерастворимых носителях отличается простотой и достигается при контакте водного раствора фермента с носителем (статистическим способом, при перемешивании, динамическим способом с использованием колонок). С этой целью раствор фермента смешивают со свежим осадком, например, гидроксида титана, и высушивают в мягких условиях. Активность фермента при таком варианте иммобилизации сохраняется практически на 100 %, а удельная концентрация белка достигает 64 мг на 1 г носителя.
К недостаткам адсорбционного метода относится невысокая прочность связывания фермента с носителем (при изменении условий иммобилизации могут происходить десорбция фермента, его потеря и загрязнение продуктов реакции). Прочность связывания фермента с носителем может повысить предварительная модификация носителя (обработка ионами металлов, полифункциональными агентами – полимерами, белками, гидрофобными соединениями, монослоем липида и пр.). Иногда, модификации подвергается молекула исходного фермента, однако зачастую это ведет к снижению его активности.
Иммобилизация ферментов путем включения в гель. Способ иммобилизации ферментов путем включения в трехмерную структуру полимерного геля широко распространен благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но и мулътиэнзимных комплексов и даже интактных клеток. Иммобилизацию ферментов в геле осуществляют двумя способами:
· фермент вводят в водный раствор мономера, а затем проводят полимеризацию, в результате которой возникает пространственная структура полимерного геля с включенными в его ячейки молекулами фермента; используют гели полиакриламида, поливинилового спирта, поливинилпирролидона, силикагеля;
· фермент вносят в раствор уже готового полимера, который впоследствии переводят в гелеобразное состояние; используют гели крахмала, агар-агара, каррагинана, агарозы, фосфата кальция.
К преимуществам иммобилизация ферментов в гелях относят:
· равномерное распределение энзима в объеме носителя;
· высокая механическая, химическая, тепловая и биологическая стойкость матрицы;
· возможность многократного использования фермента, включенного в его структуру.
Однако метод непригоден для иммобилизации ферментов, действующих на водонерастворимые субстраты.
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа иммобилизации – отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы фермента.
Наибольшее распространение получили две модификации этого метода – микрокапсулирование и включение ферментов в липосомы.
Микрокапсулирование состоит в том, что водный раствор фермента включается внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером.
Размер получаемых капсул составляет десятки или сотни микрометров, а толщина мембраны – сотые доли микрометра.
Достоинства метода микрокапсулирования:
· простота;
· универсальность;
· возможность многократного использования нативного фермента (фермент может быть отделен от непрореагировавшего субстрата и продуктов реакции процедурой простого фильтрования);
· возможность иммобилизовать не только индивидуальные ферменты, но и мультиэнзимные комплексы, целые клетки и отдельные фрагменты клеток.
К недостаткам метода следует отнести невозможность инкапсулированных ферментов осуществлять превращения высокомолекулярных субстратов.
Включение водных растворов ферментов в липосомы. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель. Оставшуюся тонкую пленку липидов диспергируют в водном растворе, содержащем фермент. В процессе диспергирования происходит самосборка бислойных липидных структур липосомы, содержащих включенный раствор фермента.
Ферменты, иммобилизованные путем включения в структуру липосом, используют преимущественно в медицинских и научных целях. Изучение липосом имеет большое значение для понимания закономерностей процессов жизнедеятельности клетки, поскольку значительная часть ферментов в клетке локализована в составе липидного матрикса биологических мембран.
Химические методы иммобилизации ферментов. Иммобилизация ферментов путем образования новых ковалентных связей между ферментом и носителем – наиболее массовый способ облучения промышленных биокатализаторов.
В отличие от физических методов этот способ иммобилизации обеспечивает прочную и необратимую связь фермента с носителем и часто сопровождается стабилизацией молекулы энзима. Однако расположение фермента относительно носителя на расстоянии одной ковалентной связи создает трудности в осуществлении каталитического процесса. Фермент отделяют от носителя с помощью вставки (сшивка, спейсер), в роли которой чаще всего выступают бифункциональные и полифункциональные агенты (бромциан, гидразин, сульфурилхлорид, глутаровый диальдегид и др.).
Принципиально важно, чтобы в иммобилизации фермента участвовали функциональные группы, не существенные для его каталитической функции. Так, гликопротеины обычно присоединяют к носителю через углеводную, а не через белковую часть молекулы фермента.
Все методы химической иммобилизации классифицируют в зависимости от природы реакционной группы носителя, вступающей во взаимодействие с молекулой фермента.
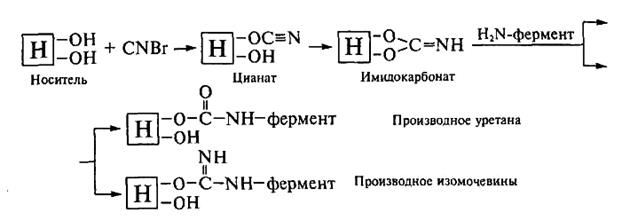
Иммобилизация ферментов на носителях, обладающих гидроксогруппами. Наиболее распространенным методом образования ковалентной связи между ферментом и полисахаридным носителем или синтетическим диольным соединением является бромциановый метод. При обработке носителя бромцианом возникают реакционноспособные цианаты и имидокарбонаты, которые при взаимодействии с нуклеофильными аминогруппами фермента образуют производные изомочевины и уретанов:
Иммобилизация ферментов на носителях, обладающих аминогруппами. Первичные аминогруппы носителя, связанные с ароматическим кольцом, предварительно превращают в соли диазония, которые затем подвергают разнообразным реакциям сочетания. В реакции сочетания вступают фенольные, имидазольные, аминные, гуанидиновые, тиольньте группы белков.
Иммобилизация на носителях, обладающих активированными производными карбоксильной группы. Наиболее часто для соединения аминогрупп белка с ацильными группировками носителя используют ангидриды, галогенангидриды, активированные эфиры и другие производные карбоновых кислот.
Иммобилизация на носителях, обладающих сульфгидрильными группами. Сульфгидрильные группы носителя и фермента легко окисляются с образованием дисульфидных связей под действием кислорода воздух:
Н—SН +НS—Ф + О2→Н— S—S —Ф + Н2О
Преимущества химической иммобилизации – высокая эффективность и прочность связи. Однако, методы ковалентной иммобилизации малодоступны для промышленного использования в связи со сложностью и дороговизной их применения.
Дата добавления: 2016-10-26; просмотров: 11427;











