Цементы со специальными свойствами
В европейских стандартах особенные свойства цементов до сих пор не регулируются, но остаются специальные требования, которые действуют по стандарту DIN 1164. В нем регулируются следующие свойства:
• NW- цементы с низкой теплотой гидратации;
• HS - цементы с высоким сопротивлением сульфатной агрессии;
• NA - цемент с низким содержанием эффективной щелочи.
Возможные специальные требования для различных видов цемента, приведены в таблице 1.18.
Таблица 1.18- Специальные требования к цементам со специальными свойствами в соответствии с DIN 1164 [113]
| Цемент | Требования | Методы испытаний |
| NW-цемент | ||
| CEM I к CEM V | Гидртация после 7 суток ≤270 J/g | DIN EN 196-8 |
| HS цемент | ||
| CEM I | Содержание C3A ≤3,0%а Содержание Al2O3 ≤5,0% | DIN EN 196-2 |
| CEM III/B CEM III/C | Состав после таблицы 1 из DIN EN 197-1:2000 | Цемент-Известь-Гипс 49 (1996) Nr 2, S. 108 – 113. |
| NA-цемент | ||
| CEM I к CEM V | ≤0,60% Na2O-Эквивалентb | DIN EN 196-21 и Цемент-Известь-Гипс 49 (1996) Nr 2, S. 108 - 113 |
| CEM II/B-S | ≥21% доменный и ≤0,70% Na2O-Эквивалент | |
| CEM III/A | ≤49% доменный и ≤0,95% Na2O-Эквивалент | |
| ≥50% доменный и ≤1,10% Na2O-Эквивалент | ||
| CEM III/B | Состав после таблицы 1 из DIN EN 197-1:2000 и ≤2,00% Na2O-Эквивалент | |
| CEM III/C | Состав после таблицы 1 из DIN EN 197-1:2000 и ≤2,00% Na2O-Эквивалент | |
| а) Содержание трехкальциевого алюмината (С3А; 3CaO·Al2O3) составляет = 2,65 х Al2O3, вычисляется как массовая доля в % в соответствии с уравнением С3А - 1,65xFe2O3. Для этого, химический анализ потерь на цементе зажигания корректируется CaCO3, акции CaSO4, которые будут определены в соответствии с DIN EN 196-21. б) Применяется широко, более NA цементами см следующие строки (см пояснения). |
Тампонажный цемент
В добыче нефти и газа при бурении скважин для герметизации нефтяных, газовых и водоносных пластов производится цементирование так называемого кольцевого пространства. Эти стандартизированные скрепленные металлические трубы (так называемые корпус), диаметр которых составляет не менее 5 см меньше диаметра отверстия, вводимого в нижнее отверстие и цементируется посредством введения тампонажных растворов между стенкой ствола скважины и трубой. Цементная мантия служит для закрепления трубы в скважине по которой будет выкачиваться нефть и природный газа, а также для защиты от соленых и коррозионных депозитных вод. Цементный раствор закачивается снизу в кольцеобразное пространство между трубой и окружающей породой. Детали метода глубокого бурового цементирования описаны в разделе 4.5 о буровом цементировании.
Цементы, используемые в буровом цементировании должны удовлетворять специальным требованиям. Они должны работать при высоких температурах и давлениях (в настоящее время при технических температурах до 250 °С и давлении до 1500 бар), должны иметь низкую вязкость и закачиваться на расстояния до 20 км полностью заполняя кольцевое пространство, а затем быстро схватываться и затвердевать. Особое значение придается точно калиброванному времени затвердевания и упрочнения цемента. Из-за повышенной температуры в стволе скважины обычный цемент быстро схватывается и затвердевает в кольцевом пространстве, цемент не успевает прокачиваться до конца и цементирование будет неполным.
Схватывание цементных растворов задерживают путем добавления лигносульфонатов, карбоксилат-синтетических полимеров (например AMPS - сополимеров акриловой кислоты) или винной кислоты. Наиболее широко распространены лигносульфонатные замедлители, которые используются для температур до 150 °С. Подходящие замедлители должны с одной стороны достаточно надолго задерживать сроки схватывания цемента ( в зависимости от глубины скважины 3-6 ч), а с другой стороны после схватывания быстро набирать достаточную прочность. И, наконец, цемент должен затвердевать настолько быстро, насколько это возможно, и позволять продолжить операции бурения.
Минимальная прочность на сжатие должна быть 3,45 МПа (500 фунтов на квадратный дюйм). Этой прочности достаточно, чтобы выдерживать удары во время бурения. Так как современные офшорные буровые установки в день имеют эксплуатационные расходы более чем на S 250000, минимально возможное время ожидания для затвердевания цемента экономически очень важно. Используемая для затворения вода и подземная вода иногда может содержать увеличенные количества сульфатов кроме NaCl, CaCl2, MgCl2. Поэтому предпочтительно использовать сульфатостойкие цементы с низким содержанием C3A. Для придания тампонажному раствору требуемых свойств, таких как плотность, текучесть и контроль потерь воды из цементной суспензии, используется ряд узкоспециализированных добавок и примесей, с которым тампонажный цемент должен показать требуемые согласно договора свойства. В настоящее время годовое потребление тампонажных цементов составляет около 1 миллиона тонн.
Во многих странах существуют нормы и правила для композиции, для тестирования и использования цементов. Во всем мире наиболее важными для тампонажных материалов являются положения "Американского института нефти" (API) [114, 115]. Они признаны практически во всех странах или являются частью национальных стандартов. В спецификации API 10A приводится восемь маркировок классов цементов от А до Н, которые существенно отличаются по их клинкерной композиции и, таким образом, регулируют их стабилизацию и твердение в зависимости от температуры. В таблице 1.19 приведены типичные клинкерные композиции 8 классов цементов и рекомендованные стандартом API области их применения в зависимости от глубины скважин и температурных диапазонов. Характеристика всех цементов (за исключением двух типов классов А и С) очень мало отличается по сравнению с кладочными цементами, содержащими C3А. Он вызвал медленный подъем и затвердевание цемента и, таким образом, обеспечивает более длительное пребывание в жидкотекучем состоянии.
Таблица 1.19- Состав и области глубокого бурения для цементов в соответствии с API
| Класс API | Среднее содержание клинкерных фаз, % | Водоцемент-ное отношение | Глубина скважины, м | Диапазон темпера-тур, оС | |||
| C3S | C2S | C3A | C4AF | ||||
| A | 8+ | 0,46 | 0-6000 | 27-77 | |||
| B | 5- | 0,46 | 0-6000 | 27-77 | |||
| C | 0,55 | 0-6000 | 27-77 | ||||
| D | 0,38 | 6000-12000 | 77-127 | ||||
| E | 0,38 | 6000-14000 | 77-127 | ||||
| F | 0,38 | 10000-16000 | 77-143 | ||||
| G | 0,44 | 0-8000 | 115-160 | ||||
| H | 0,38 | 0-8000 | 27-93 |
В принципе, все портландцементы хорошо цементируют скважины. Они отличаются от обычных цементов стандартным требованием, что они должны быть произведены без добавления вторичного сырья и дистиллятного топлива. Не могут быть использованы даже интенсифицирующие добавки. Цементы, как правило, производятся в периодическом режиме с тонкостью помола 3000 см2/ г по Блейну, т.е. они относительно крупнозернистые. Сегодня используются две базы цементов класса G и класса H. Их тампонажно-технические управляемые свойства могут быть скорректированы с подходящими замедлителями для использования практически на любой требуемой скважинной температуре до 250 °C и, таким образом, они являются универсальными цементами. По стандарту API цементный раствор класса G испытывается при В/Ц отношении равном 0,44, цементы класса H испытываются при В/Ц отношении равном 0,38. Эти показатели лишь немногим отклоняются на практике.
Скважинное давление повышает температуру и приводит к ускорению твердения портландцемента и, следовательно, хорошо ускоряет цементирование скважин, ускоряется образование продуктов гидратации. В результате при температуре около 110 °С С-S-H гель образует а-С2SH высшей степени кристалличности и, таким образом, большая часть продуктов гидратации приобретает более высокую плотность. Этот процесс преобразования требует сильной усадки и частичной потери прочности затвердевшего цементного камня, с разрушительными последствиями для плотности скважины [116, 117]. На стандартизованных класса G- цементных растворах снижение прочности при сжатии может составить 80% и 100-кратное увеличение водопроницаемости (обычно 0,1 mDarсy) которое наблюдается при 230 °С. Это как "сила регресса". Отмеченная проблема технически решается путем уменьшения отношения CaO:SiO2 - раствора соотношение примерно 1. С этой целью для нефтяных скважин, работающих при температурах свыше 110 °С, приготавливают цементные растворы, содержащие 30-40 % кварцевой муки. В этих условиях, получаются в качестве предпочтительной фазы C-S-H - тоберморитоподобный (C5S6H5) минерал, который не образуется при нормальной температуре.
При повышенных температурах также и алюминаты кальция формируются в другие гидратные продукты. Это превращает C3A при температуре около 80 °C в гексагональный C2AH8 вместо кубического C3AH6 (катоит). Эттрингит при температуре около 110 °С теряет стабильность и разлагается с образованием С-А-Н фазы и полугидрата CaSO4.
Буровой цемент, в частности, два базовых цемента класса G и класса H подходят из-за их четко определенного состава и способа приготовления также для изготовления сложных ответственных строительных конструкций вне нефтяных и газовых скважин. Их чистота и особенности качества делают их интересными для научных исследований.
Гидратация
Гидратация это процессы реакции, в которых вода связывается с клинкерными минералами в продукты гидратации и упоминаются какгидраты или гидратные фазы, одновременно с гидратацией цемента происходит его затвердевание; жидкий раствор или пластичное цементное тесто переходит в твердый цементный камень. Затвердевание делится на практике на две стадии: схватывания и твердения. Сразу же после контакта воды и цемента происходит образование гидратов, которые первоначально приводят к небольшому повышению прочности цемента, далее прочность усиливается. Достигаемые прочности заранее взаимосвязаны с величиной определенной консистенции цементной пасты. Первоначально это не упругий продукт. Только после длительной прогрессивный гидратация, которая способствует образованию прочной микроструктуры, в конечном счете приводит к прочному затвердеванию и, таким образом, образованию прочного надежного продукта. В процессе затвердевании в первую очередь алюминатные фазы взаимодействуют с сульфатом кальция, за дальнейшее упрочнение цементного камня ответственны силикатные фазы. Цемент представляет собой гидравлическое вяжущее вещество. Соответственно, гидратация осуществляется как на воздухе, так и под водой. Цементный камень - в отличие от штукатурки, является водонепроницаемым. Продукты, образовавшиеся в процессе гидратации, практически нерастворимы в воде. Сумма этих свойств дает портландцементу свои уникальные возможности в качестве строительного материала.
Массовое соотношение при добавлении воды к цементу называется водоцементное отношение (вода/цемент, В/Ц).
В процессе гидратации и затвердевания цемента различные химические процессы протекают параллельно и последовательно. Они часто очень сложны, так как отдельные клинкерные фазы не являются независимыми друг от друга, реагируют и могут влиять друг на друга. В частности, это химические реакции, гидратации и реакции гидролиза
Полученный раствор и процессы кристаллизации, в которых формируется гель и кристаллизуются гидратированные новообразования (гидраты), происходят из пересыщенных растворов и в результате топохимических процессов.
Для более подробного описания процессов гидратации 4 основных фаз клинкера (алит, белит, алюминат и алюмоферриты) сначала они рассматриваются отдельно. Порядок и скорость протекания реакции можно контролировать с помощью определения состава фазовых новообразований, измерения выделяющегося при гидратации тепла, потребление воды и измерения электрического сопротивления цементного теста. Особенно важными являются реакции гидратаци алюмината и алита, белит реагирует медленнее, но идентично алиту. Феррит не оказывает существенного влияния.
1.1.10.1 Реакция силикатов (C3S, C2S)
В реакциях гидратации силикатов с водой формируются различные продукты гидратации - гидросиликаты кальция, содержащие СаО, SiO2 и H2О. В разных гидросиликатах различных композиций изменяется соотношение вода/цемент. Поэтому в общем случае, для продуктов гидратации силикатов кальция используется обозначение C-S-H-фазы. Эти обозначения могут варьироваться, чтобы проиллюстрировать стехиометрию образуюшихся гидратов.
Гидратация C3S
Алит реагирует с водой с образованием Са(ОН)2 – гидроксида кальция) гидросиликатов кальция (С-S-H-фазы). Возможные продукты реакции C6S2H3, C2S3H2 или C2SH, однако в основном образуется очень мелкокристаллический и, следовательно, рентгеноаморфный гидросиликат. Состав C-S-H-фазы зависит от конкретного водоцементного отношения. В общем случае, чем выше соотношение вода/цемент, тем выше дефицит кальция из образованного гидрата силиката кальция. При соотношении вода/цемент равном 0,45, например, возникает C3S2H3 согласно следующего уравнения:
2C3S + 6H2О → C3S2H3 + 3Cа(ОH)2 Уравнение 16
Гидратация C3S в общем случае может быть сформулирована [118]:
3CaO·SiO + xH2O → yCaO·SiO2·(y-(3-x))H2O+(3-y)Ca(OH)2 Уравнение 17
(=C-S-H) портландит
Сразу же после добавления воды из кристаллов C3S удаляется гидроксид кальция. В рамках своей растворимости Са(ОН)2 диссоциирует на Са2+ катионы и анионы ОН --. Ионы ОH- приводят к уменьшению концентрации ионов Н+ в водe затворения и, таким образом, к значительному увеличению рН в растворе. В течение первых нескольких минут наблюдается быстрое увеличение рН в цементной пасте до 12-13,5. Щелочность отвечает за защиту стали от коррозии в бетоне. Высокий уровень рН и присутствие Са(ОН)2 остаются необходимым условием для протекания реакции скрытых гидравлических свойств материалов, таких как гранулированный доменный шлак и пуццоланов (например, летучей золы, трасса). Одновременно возрастает концентрация Са2+ в поровом растворе и есть освобожденная реакция теплоты. Таким образом, это является экзотермической реакцией. Скорость гидратации С3S не особенно быстрая по сравнению с другими клинкерными минералами. Тем не менее, это происходит значительно быстрее, чем сопоставимые реакции C2S с водой [121, 120, 119].
Степень тепловыделения характерна для каждой конкретной стадии гидратации и уже используется на ранней стадии, чтобы классифицировать гидратацию по отдельным стадиям. Они упоминаются как индукционный период, период покоя, период акселерации, период ретардации и заключительный период. В течение этих периодов происходят разные реакции, которые описаны в таблице 1.20. На рисунке 1.27 приведена временная диаграмма генерации тепла в течение пяти периодов, а также содержание Ca2+ в поровой воде и образованию C-S-H - фаз.
Образовавшиеся в процессе гидратации C-S-H-фазы являются рентгеноаморфными или субмикронно кристаллическими. Поэтому их образование в рентгеновской кристаллографии не наблюдается. Процесс гидратации может быть прослежен на рентгенограммах по снижению интенсивности пиков, характерных для C3S.
В литературе часто между фазами С-S-H (I) и C-S-H(II) есть различия [4]. В C-S-H (I) отношение CaO/SiО2 составляет 0,8-1,5, в C-S-H (II) соотношение должно быть 1,0-2,0. C-S-H(I) образуется в форме пластин, С-S-Н (II) описан в виде волокнистого минерала. С повышением соотношения СаО/SiO2 степень кристалличности фаз должна уменьшаться.
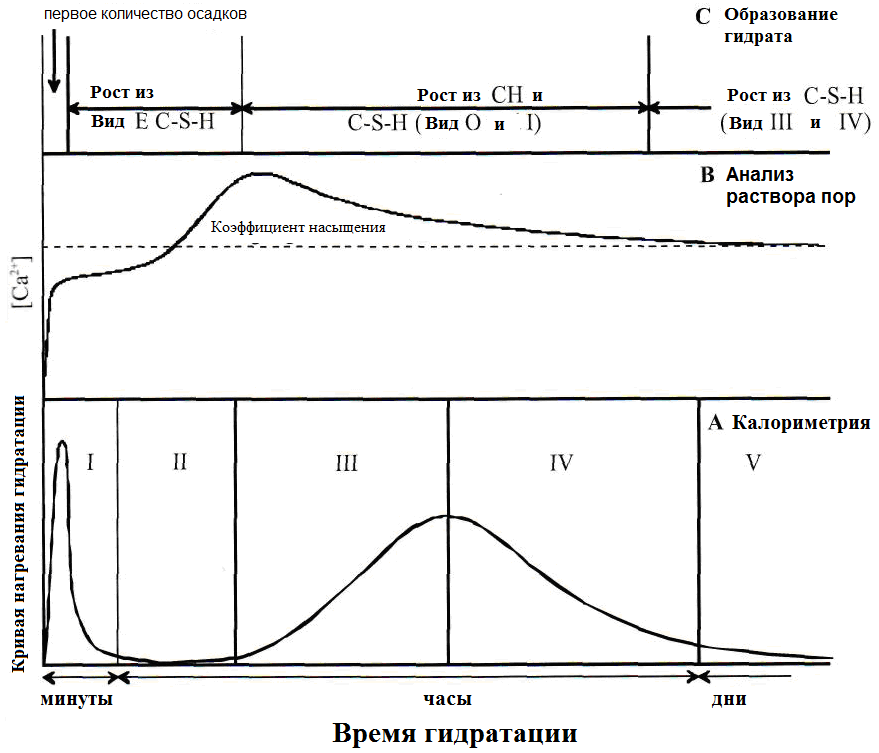
Рисунок 2.27 -Представление процессов во время гидратации C2S [121]
Как уже было описано выше, в результате гидратации силикатов кальция происходит образование определенных химических соединений, фаз, которые различаются по своему химическому составу в определенных пределах. Как «предел» может образоваться минерал тоберморит 1,4 нм (C5S6H9, названный в честь шотландского города Tobermory) и дженнит (C9S6H11). Тоберморит это природный минерал. Дженнит в отличие от него в природе не встречается. Оба минерала образуются в затвердевшей цементной пасте. Он может быть получен
Таблица 1.20-Последовательность реакций гидратации C3S и устранение неоднозначности [122]
| Период | Этап | Немецкое обозначение | Англо-саксонское обозначение | Кинетика реакции | Химический процесс | Воздействие на цемент или цементный камень | |
| Ранний | I | Индукционный период, начальный гидролиз | Пред-индукционный период | Химическая, контролируется, очень быстрая реакция | Начало гидролиза, ионы растворяются | Установка базового значения рН | |
| II | Бездействующий период | Индукционный (бездействующий) период | Скорость нуклеации, медленная реакция | Ионы дальше растворяются, образование ранних C-S-H-фаз | Загустевание и время схватывания | ||
| Сред- ний | III | Период акцелерации | Ускоренный (пост-индукция) период | Химическая, контролируется, быстрая реакция | Начало образования и рост постоянной гидратации | Конец схватывания и начало твердения | |
| IV | Период запаздывания, период замедления | Период замедления | Химическая и контролиремая диффузией, умеренная реакция | Дальнейший рост гидратации, образование микроструктур | Определяет развитие ранней прочности | ||
| Поздний | V | Заключительный период, непрерывный период | Диффузионный (стационарное состояние) период | Диффузия контролируется, медленная реакция | Медленное образование C-S-H-фазы, постепенное сжатие микроструктур | Определяет развитие полной прочности |
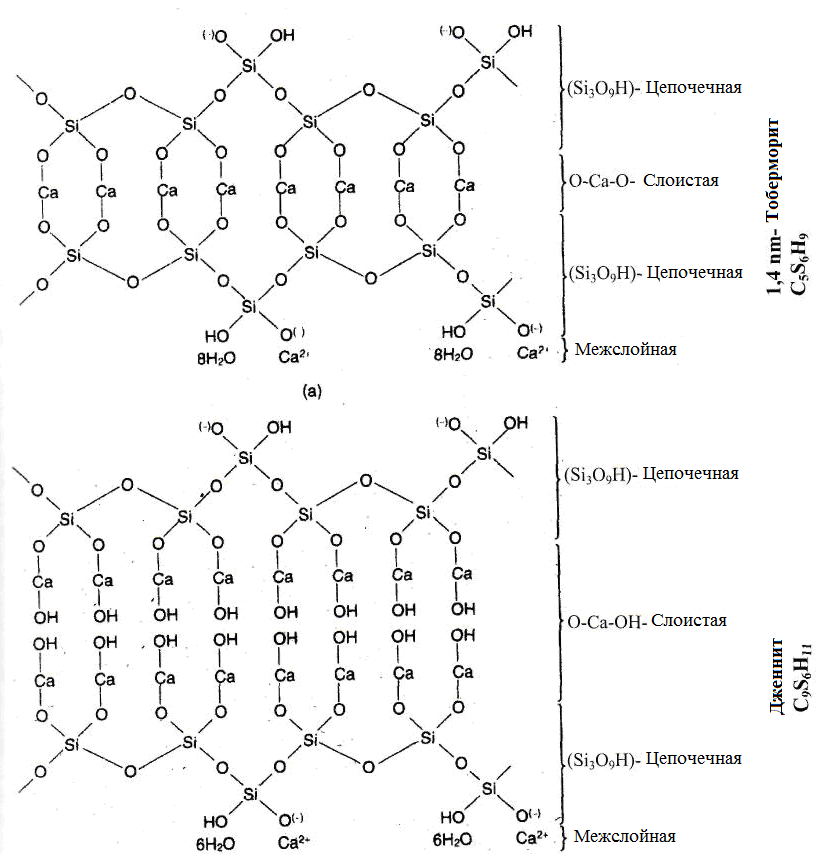
Рисунок 1.28 - Структура 1,4 нм тоберморита и дженнит [120]
синтетически и формируется, например, при гидротермальном твердении известкового песчаника или силикатного бетона. В зависимости от концентрации воды является промежуточным слоем из тоберморита 1,4, 1,1 или 0,9 нм. Структура 1,4 нм тоберморита и дженнита показана на рисунке 1.28. Когда концентрация кальция более бедная, тоберморит образуется как два слоя SiO4 тетраэдров, связанных между собой кальциевыми мостиками, когда содержание кальция богаче - дженнит контрастен, слои SiO4 тетраэдров концевых групп Ca-OH разделены [121,120].
В пределах тоберморита и дженнита ряд C-S-H-фазы с определенным составом, были определены в затвердевшем цементе. Для того, чтобы посчитать их:
• C2SH - Гиллебрандит
• C2S3H2 - Гиролит
• C3S3H2 - Aффвиллит
• С4S3H - Фошагит
• C6S6H - Ксонотлит
Движущей силой для гидратации силикатных фаз C3S и C2S является преобразование энергетически стабильных фаз. Искажения решетки, вызываемые ионами примесей, могут быть выделенными. Превращения приводят в прогрессированию полимеризации силикатных анионов из мономерного иона SiO42- с преобразованием в соответствии с рисунком 1.29 первоначально в димеры и в дальнейшем в полимерные силикатные структуры. Мохан и Тейлор исследовали превращение чистых C3S в неорганическом полимере, определенное по степени конденсации триметилсилицированного кремнезема. На рисунке 1.30 показан временной ход степени конденсации кремниевой кислоты [123].
Рентгеновская структура C-S-H-фазы может выяснена, например, путем использования ЯМР-спектроскопии (ЯМР-спектроскопия ядерного магнитного резонанса) . С помощью этого метода определяется связывание кремния в тетраэдрах SiO4 и, следовательно, может быть определена величина степени конденсации SiO4. Этот метод показал, что степень конденсации кремниевой кислоты увеличивается в C-S-H геле вместе с прогрессирующей гидратацией. Перед гидратацией в основном степень конденсации изолированных тетраэдров SiO4 равна 0 (степень конденсации Q = 0). С прогрессивной гидратацией увеличивается степень конденсации и образуются силикаты двух SiO4 - тетраэдров (единиц Si2O7), что другой SiO4 - можно прикрепить тетраэдр. Исследования ЯМР показывают, что тетраэдры SiO4 в высокой степени конденсации образуя цепочки и не слоистые (двумерные) или как рамки (трехмерный) связаны друг с другом. Это согласуется с кристаллической структурой в соответствии тоберморита и дженнита [4,124, 125, 126].
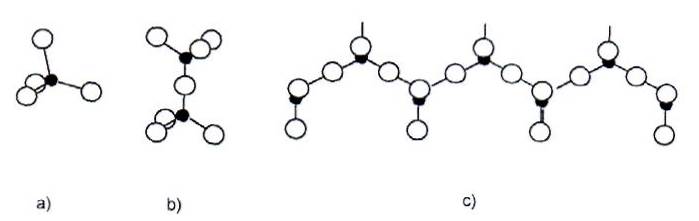
Рисунок 1.29- а) мономерный силикат анион с характерной тетраэдрической структурой; б) димер; в) полимерные силикатные цепи [33]
Две типичные, относительно хорошо определенные микрокристаллические фазы гидросиликатов кальция представляют собой С-S-H (I) и C-S-H (II). В то время как гидросиликаты кальция (ГСК) типа С-S-Н (I) кристаллизуется в форме округлых, чешуйчатых частиц, соединения типа C-S-H (II) построены в форме чешуек, листков, округлых частиц, тем не менее листки закручиваются в трубочки («закатаны») и присутствуют в виде пучков волокон [120]. Какой из этих двух структур, образуется предпочтительнее, зависит не только от температуры и количества доступной воды, но особенно от соотношения CaO / SiO2.
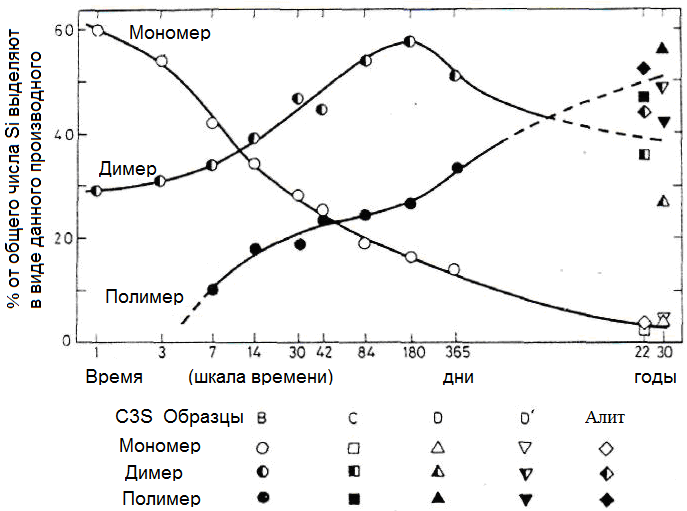
Рисунок 1.30 - Временной ход образования полимерных цепей в силикатных C-S-H-фазах [123]
Если это отношение ниже 1,5, предпочтительно образуются фазы типа C-S-H (I), в то время как с соотношением CaO/SiO2 выше 1,5 образуются фазы типа C-S-H (II). Кроме того, тип C-S-H (II), по-видимому, формируется предпочтительным при очень низком соотношении вода/связующее (значение B/Ц) и при повышенных температурах. Недавние исследования, особенно полученные с выводами ESEM в настоящее время показывают, что предварительное разделение C-S-H (I) и (II), а также их образование в форме листочков, таблеток применимо только ограниченно (смотри ниже) [5, 121, 120,127].
В гидратации силикатов имеются также различия между «внутренним» и «внешним» гидросиликатами. Внутренняя С-S-Н образует плотную массу вместо исходного материала. Внешняя С-S-H образует полосы и волокна, которые торчат в заполненном водой зазоре. Последние богаты СаО и содержат больше Аl2O3, K2O и SO3. С помощью реактивного кремнезема, молярное отношение CaO / SiO2, может уменьшиться до примерно 1.

Рисунок 1.31-РЭМ-изображения гидратации из C3S; слева вверху: время гидратации 10 мин, C3S-зерно; справа вверху: время гидратации 40 мин, зенкерование реакционного слоя и начало образования C-S-H-фазы; внизу слева: 2 часа гидратация, начальное развитие C-S-H- фазы (длина 200-300 нм, диаметр 50 нм); справа внизу: гидратация 60 d, развитые, 1,5 µm длинной C-S-H-фазы

Рисунок 1.32- Образование портландита при гидратации силикатных фаз; слева вверху: 100-300 нм кристаллы ядра на поверхности зерна C2S, образовавшиеся после того, как 10 d гидратации; Справа вверху: слоистый портландит формируется из C3S после 60 d; слева внизу: Деталь синеватой структуры портландит кристалла (C3S, 60 d гидратация); справа внизу: гексагональной портландит кристалл микроструктуры цементного камня (CEM I 32,5R, 1 d гидратация)
Гидратация C2S
Реакция чистого дикальция C2S с водой очень похожа на вышеописанную реакцию C3S. Первичными продуктами гидратации также являются C-S-H-фазы и Са(ОН)2. Так как в C2S содержание CaO меньше, чем в C3S, то образуется меньше гидроксида кальция, полученного в ходе первоначального гидролиза (см. уравнение 18). Реакция двухкальциевого силиката с водой также экзотермическая, но она происходит значительно медленнее, чем реакция C3S с водой.
Состав гидрационных продуктов из C2S зависит от температуры и содержания воды. В общем, гидратация C2S выражена следующим образом:
2CaO·SiO2+хН2О → уСаО·SiO2·(у-(2-х))H2O+(2-у)Ca(OH)2 Уравнение 18
(= C-S-H) Портландит
пример:
2 C2S + 5H → C3S2H4 + CH
Морфология C-S-H-фазы образующейся из β-C2S в значительной степени идентична C3S (см. рисунок 1.33).

Рисунок 1.33- β-C2S гидратированный 150 d
1.1.10.2 Реакции гидратации алюмината (C3A)
Дата добавления: 2016-10-26; просмотров: 3924;











