Классификация методов комплексонометрического титрования
Метод прямого титрования. Анализируемый раствор, содержащий катионы определяемого металла, разбавляют в мерной колбе и берут для титрования аликвотную часть раствора.
Титрование ведут стандартным раствором ЭДТА в щелочной среде с эриохромом черным Т или в кислой среде с ксиленовым оранжевым.
Для этого титруемый раствор предварительно перед титрованием доводят до определенного значения рН при помощи буферного раствора. Наряду с буферным раствором иногда добавляют еще вспомогательный комплексующий агент (тартрат, цитрат и др.), связывающий некоторые катионы и удерживающий их в растворимом состоянии во избежание выпадения осадков гидроокисей в щелочном растворе.
В процессе прямого титрования концентрация определяемого катиона сначала снижается постепенно, затем вблизи точки эквивалентности резко падает. Этот момент замечается по изменению окраски введенного индикатора, мгновенно реагирующего на изменение концентрации катионов металла-комплексообразователя.
Методом прямого комплексонометрического титрования определяют Cu2+, Cd2+, Pb2+, Ni2+, Со2+, Fe3+, Zn2+, ThIV, Al3+, Ba2+, Sr2+, Ca2+, Mg2+ и некоторые другие катионы. Определению мешают комплексующие вещества, удерживающие определяемые ионы в виде комплексных ионов, которые не разрушаются комплексонами.
Метод обратного титрования. В тех случаях, когда по тем или иным причинам невозможно провести прямое титрование определяемого катиона, пользуются методом обратного титрования. К анализируемому раствору прибавляют точно измеренный объем стандартного раствора комплексона, нагревают до кипения для завершения реакции комплексообразования и затем на холоду оттитровывают избыток комплексона титрованным раствором MgSO4 или ZnSO4. Для установления точки эквивалентности применяют металл-индикатор, реагирующий на ионы магния или цинка.
Метод обратного титрования применяют в тех случаях, когда нет подходящего индикатора на катионы определяемого металла, когда в буферном растворе катионы образуют осадок и когда реакция комплексообразования протекает медленно. Методом обратного титрования также определяют содержание катионов в нерастворимых в воде осадках (Са2+ в СаС2О4, Mg2+ в MgNH4PO4, Pb2+ в PbSO4 и т. п.).
Метод титрования заместителя. В некоторых случаях вместо описанных выше методов пользуются методом титрования заместителя. Метод комплексонометрического титрования заместителя основан на том, что Mg2+-ионы дают с комплексоном менее устойчивое комплексное соединение (рК = 8,7), чем подавляющее большинство других катионов. Поэтому, если смешать катионы определяемого металла с магниевым комплексом, то при этом произойдет реакция обмена.
Например, эта реакция используется для определения ионов тория, когда в анализируемый раствор предварительно вводят комплексонат магния MgY2 ‑, а затем оттитровывают выделившиеся Mg2+-ионы стандартным раствором ЭДТА (б);
| Th4+ + MgY2 ‑ | 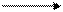 рН = 2 рН = 2
| ThY + Mg2+ | (а) |
| Mg2+ + H2Y2 ‑ | 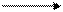 рН=10 рН=10
| MgY2 ‑+2H+ | (б) |
Вследствие того, что ThIV образует с комплексоном более устойчивое комплексное соединение, чем Mg2+, равновесие реакции (а) сдвигается вправо.
Если по окончании реакции вытеснения оттитровать Mg2+ стандартным раствором ЭДТА в присутствии эриохром черного Т, то можно рассчитать содержание ТhIV-ионов в исследуемом растворе.
Метод кислотно-основного титрования. В процессе взаимодействия комплексона с теми или иными катионами металлов выделяется определенное количество эквивалентов ионов водорода.
Образующиеся при этом в эквивалентном количестве ионы водорода оттитровывают обычным алкалиметрическим методом в присутствии кислотно-основного индикатора или другими способами.
Существуют и другие методы комплексонометрического титрования, описание которых не входит в нашу задачу.
Дата добавления: 2021-01-26; просмотров: 439;











