КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ). Характеристика метода
Впоследнее время в заводских и научно-исследовательских лабораториях широко применяют методы анализа, основанные на использовании реакций, которые сопровождаются образованием комплексных соединений катионов с органическими реактивами — комплексонами. Образующиеся соединения называют внутрикомплексными (клешневидными, хелатными) солями.
Понятие о комплексонах.Комплексонами обычно называют органические соединения, представляющие собой производные аминополикарбоновых кислот. Простейший комплексон — нитрилотриуксусная кислота (НТА, комплексон I, сокращенно H3Y):
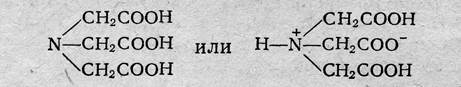
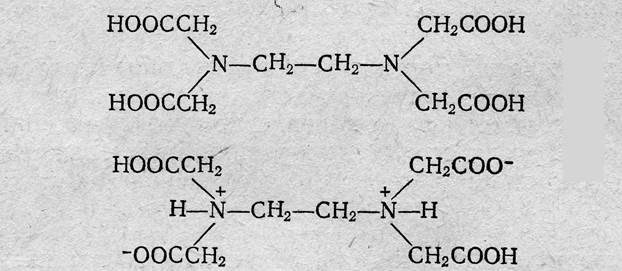
Наибольшее значение имеет четырехосновная этилендиаминтетрауксусная кислота (ЭДТУ, комплексон II, сокращенно H4Y):
Комплексоны наряду с карбоксильными группами (—СООН) содержат аминный азот (≡≡ N). Благодаря такому строению эти соединения отличаются мульти (поли) дентатностью, т. е. способностью образовывать сразу несколько координационных связей с ионами металлов-комплексообразователей.
На практике обычно применяют двунатриевую соль этилендиамин-тетрауксусной кислоты (ЭДТА, Na-ЭДТА, комплексон III или трилон Б, сокращенно Na2H2Y):
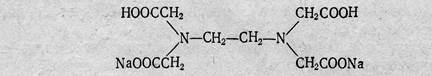
ЭДТА образует со многими катионами устойчивые малодиссоциированные растворимые в воде внутрикомплексные соли, построенные по типу известной комплексной соли диметилглиоксимата никеля.
С некоторыми ионами металлов-комплексообразователей комплексоны образуют настолько устойчивые слабые электролиты, что обычными качественными реакциями невозможно доказать присутствие данного катиона в растворе этого комплексного соединения.
Реакции между комплексоном и ионами металлов-комплексообразователей протекают стехиометрически, т. е. в строго эквивалентных отношениях; это обстоятельство открывает широкие возможности применения комплексонов для количественного определения многих катионов, в том числе кальция, цинка, меди алюминия, индия и др.
Применение комплексонов в аналитической химии. Комплексоны имеют ряд характерных особенностей:
1) хорошо растворимы в воде и некоторых других растворителях;
2) легко реагируют со многими катионами металлов (и в том числе с катионами щелочноземельных металлов, не образующих, как правило, комплексных соединений с другими комплексующими реагентами) с образованием растворимых в воде устойчивых комплексных соединений;
3) некоторые обладают избирательным действием по отношению к тем или иным катионам.
Указанные особенности комплексонов обусловили широкое применение их в качестве титрантов в новой области аналитической химии, называемой комплексонометрией, и в качестве маскирующих агентов.
Известно большое число методов маскировки ЭДТА и другими комплексонами щелочноземельных, тяжелых, редких и рассеянных металлов, мешающих определению других ионов. Например, ЭДТА маскирует катионы многих металлов, мешающих определению бериллия титриметрическими, фотометрическими, спектрофотометрическими, экстракционно-фотометрическими и другими методами.
Использованию комплексонов в качестве маскирующих агентов способствовало то обстоятельство, что комплексонаты металлов имеют различные константы нестойкости (рКнест) и образуются при определенных значениях рН растворов.
Комплексонометрическое титрование. Комплексоны широко используются для комплексонометрического титрования многих катионов и анионов (косвенным методом). При этом используют метод прямого и обратного титрования. Впервом случае титрование ведут при определенном значении рН стандартным раствором ЭДТА. Точку эквивалентности устанавливают с помощью индикаторов, представляющих собой органические красители, образующие с катионами окрашенные комплексные соединения (металл-индикаторы).
При титровании ЭДТА такого окрашенного комплексного соединения оно постепенно разлагается вследствие образования нового более прочного внутрикомплексного соединения катиона с комплексоном. В точке эквивалентности первоначальный цвет комплексного соединения, образуемого, индикатором с определяемым катионом, исчезает и появляется окраска, свойственная свободномуиндикатору.
При" обратном методе титрования к анализируемому раствору прибавляют отмеренный объем стандартного раствора ЭДТА, избыток которого оттитровывают стандартным раствором соли цинка (или другого металла) в присутствии металл-индикатора, реагирующего на ионы цинка (или ионы другого металла).
Таким образом, комплексонометрия представляет собой титримет-рический метод анализа, основанный на использовании реакций ионов металлов-комплексообразователей с комплексонами, сопровождающихся образованием устойчивых малодиссоциированных растворимых в воде внутрикомплексных (клешнеевидных) солей.
При титровании ЭДТА солей металлов-комплексообразователей протекают следующие реакции в заключительной стадии определения;
Na2H2Y ⇆ 2Na+ + H2Y2 ‑
Me2+(Ca2+) + H2Y2 ‑ →MeY2 ‑ + 2H+
Me3+(ln3+) + H2Y2 ‑ →MeY ‑ + 2H+
Me4+ (Тh4+) + H2Y ‑ →MeY + 2H+
Согласно приведенным уравнениям, 1 моль реагирующих с Na-ЭДТА-катионов, независимо от их степени окисления, связывает 1 моль Na-ЭДТА.
Типы реакций, используемых при комплексонометрическом титровании. В комплексонометрии применяют реакции разнообразного типа.
1. Реакции непосредственного взаимодействия ионов металла ком-плексообразователя с комплексоном; например, реакции, применяемые для определения ионов цинка в аммиачной буферной среде или ионов кальция в среде КОН и т. д. в присутствии индикатора, реагирующего на изменение рМе аналогично тому, как кислотно-основной индикатор реагирует на изменение рН раствора:
| Zn2+ + H2Y2 ‑ | pH = 10
 NH3 + NH4Cl
NH3 + NH4Cl
| ZnY2‑ + 2H+ |
2. Реакции взаимодействия избытка комплексона со стандартным раствором сульфата цинка, магния, железа (III)и т. п.; например, реакции, используемые для определения алюминия (при рН = 5 ацетатный буферный раствор), при котором комплексон прибавляют в титруемый раствор в избытке (а), а затем избыток реагента оттитровывают стандартным раствором (б):
| Al3+ + n tH2Y2 ‑ | pH = 5

| AlY ‑ +2H+ + (n – 1)H2Y2 ‑ | (а) |
| (n – 1) Zn2+ + (n – 1) H2Y2 ‑ | pH = 10 
| (n – 1) Zn Y2 ‑ +2H+ | (б) |
3. Реакции взаимодействия заместителей с определяемым элементом, завершаемые титрованием выделившихся ионов заместителя стандартным раствором ЭДТА.
4. Реакции кислотно-основного титрования, при которых замещенные ионы водорода оттитровывают стандартным раствором сильного основания в присутствии кислотно-основного индикатора (а) или иодометрическим методом (б):
| Me2+ + H2Y2 ‑ →MeY2 ‑ + 2H+ | (a) | ||
| 2Н+ + 2ОН ‑ |  метиловый красный метиловый красный
| 2Н2О | |
| ЗМе2++ 3H2Y2 ‑ + IO ‑ + I ‑ → 3MeY2 ‑ + ЗН2О + 3I2 | (б) | ||
Выделившийся иод оттитровывают тиосульфатом:
6S2O32 ‑ + 3I2 →3S4О62 ‑ + 6 I ‑
Другие типы комплексонов.Кчислу новых комплексующих реагентов относятся фосфорорганические комплексоны, являющиеся производными аминоалкилфосфоновых кислот. Например:
Этилендиаминтетраметилфосфоновая кислота (ЭДТФ)
[(HO)2P(O)CH2]2N—CH2—CH2—N[CH2P (О) (ОН)2]2
и этилендиамин - N,N' - диуксусная - N, N' - диметилфосфоновая кислота
(ЭДУФ)
| HOOCCH2 | CH2COOH | |||||||
| ╲+ | +╱ | |||||||
| NH—CH2—CH2—NH | ||||||||
| ╱ | ╲ | |||||||
| Н2О3РСН2 | СН2РО3Н2 | |||||||
Аминоалкилфосфоновые кислоты обладают комплексующими свойствами благодаря протонно-донорным функциям кислотных групп и наличию аминных атомов азота, склонных к образованию клешневидных соединений. Свойства этих комплексонов настолько разнообразны, что они дают возможность проводить дифференцированные определения в смесях.
Например, этилендиаминдиизопропилфосфоновая кислота (ЭДДИФ) не образует комплексов с ионами щелочноземельных металлов. Это позволяет комплексонометрически определять катионы элементов первого переходного периода в присутствии катионов щелочноземельных металлов.
Строение образуемых внутрикомплексных солей, Анион этиленди-аминтетрауксусной кислоты как четырехосновной кислоты, содержащей четыре подвижных иона водорода и два атома азота с основными свойствами, обладает всего шестью атомами, которые участвуют в качестве лигандов при построении пятичленных циклов внутрикомплексных соединений. Классическими примерами такого типа соединений являются:
гликоколят меди
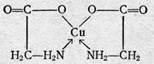
диметилглиоксимат никеля
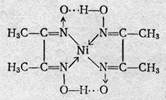
Внутрикомплексные соли образуются во всех случаях, когда ионы металла-комплексообразователя, с одной стороны, замещают активные атомы водорода функциональных групп органического соединения, а с другой стороны, — взаимодействуют с какими-либо группами, способными сочетаться с данным ионом координационной связью.
Примерами групп, содержащих ионы водорода, которые способны замещаться на ионы металлов, и взаимодействующих с ионами металла-комплексообразователя за счет главной валентности служат, карбоксильная —СООН, сульфоксильная —SO3H, оксимная =NOH, гидроксильная —ОН и другие группы.
Примерами групп, соединяющихся с ионами металла-комплексо-образователя координационной (донорно-акцепторной) связью, служат: аминогруппа —NH2, иминогруппа =NH, оксимная группа =NOH, карбонильная =СО, тиоэфирная —S— и некоторые другие.
В комплексонах группами, взаимодействующими с ионами металла-комплексообразователя за счет главной валентности, являются—СООН-группы, а побочной валентности — третичные аминогруппы.
Внутрикомплексные соли с ЭДТА образуются, с одной стороны, за счет замещения ионами металла-комплексообразователя активных атомов водорода карбоксильных групп, с которыми он соединяется главными валентностями, а с другой стороны, — взаимодействия с атомами азота, способными сочетаться с данным ионом металла-комплексообразователя посредством побочной (координационной) валентности.
Способы фиксирования точки эквивалентности. Определение точки эквивалентности при комплексонометрическом титровании может быть проведено различными способами.
Во-первых, используют обычные кислотно-основные индикаторы, так как реакция комплексообразования сопровождается выделением Н+-ионов в количестве, эквивалентном количеству определяемого катиона:
Me2+ + H2Y2 ‑ → MeY2 ‑ + 2H+
Выделившуюся кислоту определяют методом нейтрализации с обычными кислотно-основными индикаторами.
Во-вторых, применяют металл-индикаторы, представляющие собой органические красители, которые образуют с катионами определяемых элементов растворимые в воде окрашенные комплексные соединения.
Получаемые при этом комплексные соединения менее устойчивы, чем внутрикомплексные соли, образуемые определяемыми катионами с комплексонами. Поэтому в процессе титрования комплексоном раствора, содержащего окрашенное комплексное соединение, образуемое определяемыми катионами с индикатором, в точке эквивалентности наблюдается изменение окраски раствора. Это объясняется тем, что комплексное соединение индикатора разрушается и индикатор выделяется в свободном виде. Так как окраска комплексного соединения индикатора отличается от окраски свободного индикатора, то происходит изменение окраски титруемого раствора.
Схематично это можно представить следующим образом;
Kt2+ + 2HInd ⇄ Ktlnd2 + 2Н+
бесцветный окрашен окрашен в
иной цвет
Ktlnd2+H2Y2 ‑ → KtY2 ‑ + 2HInd
окрашен бесцветен окрашен
Таким образом, металл-индикатор реагирует на изменение концентрации катиона аналогично тому, как кислотно-основной индикатор ведет себя при изменении рН титруемого раствора.
В-третьих, для фиксирования точки эквивалентности применяют окислительно-восстановительные (ред-окс) индикаторы и инструментальные методы.
Индикаторы. В качестве индикаторов при комплексонометрических титрованиях часто применяют красители: кислотный хром темно-синий, кислотный хромоген черный специальный (иначе называемый эриохром черный Т или хромоген специальный ЕТ 00) и др. Эти индикаторы в щелочной среде имеют синюю окраску.
Ионы кальция, магния и ряда других металлов образуют с индикаторами внутрикомплексные соединения, окрашенные в вишнево-красный цвет. При титровании ЭДТА раствора, содержащего определяемый катион и индикатор, ионы металла переходят от молекулы индикатора к молекуле ЭДТА, при этом выделяется свободный индикатор. В точке эквивалентности красная окраска раствора переходит в синюю, свойственную индикатору.
Эриохром черный Т. Эриохром черный Т является органическим азокрасителем группы о,о’-диоксиазонафталина:
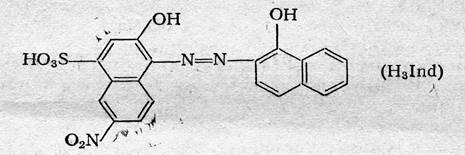
диссоциирующий с образованием Н+, H2Ind ‑, Hind2 ‑, Ind3 ‑. В его молекулу входят две фенольные группы и хромофорная азогруппа. Поэтому Эриохром черный Т способен реагировать с ионами металла-комплексообразователя с образованием комплексных соединений. Сам индикатор окрашен в синий цвет. В нейтральной или щелочной среде при рН = 7 ¸ 11 он образует с ионами металлов (Cu2+, Mg2+, Zn2+, Mn2+, In3+, Al3+ и др.) соединения красного цвета.
Уравнение реакции можно представить в следующем виде: заключительная стадия титрования ЭДТА протекает согласно уравнению
Ме2+ + HInd2 ‑ ⇄ Melnd ‑ + H+
синий красный
Melnd ‑ + Na2H2Y + ОН‑ → Na2MeY + Hind2 ‑ + Н2О
Для поддержания рН раствора на требуемом уровне обычно в титруемый раствор добавляют аммиачную буферную смесь.
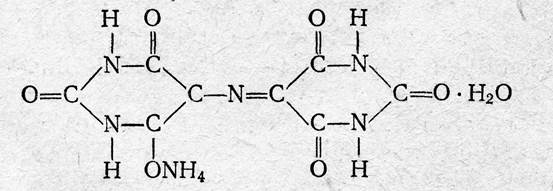
Мурексид (пурпурат аммония). Мурексид представляет собой темно-красный порошок. Водный раствор мурексида окрашен в фиолетово-красный цвет, изменяющийся в зависимости от среды: при рН = ≤9 - красно-фиолетовый, . рН = 9—10 — фиолетовый, рН >11— сине-фиолетовый. С катионами кальция, никеля, кобальта, меди и другими мурексид образует комплексные растворимые в воде соединения красного или желтого цвета, разлагаемые ЭДТА с образованием более устойчивых внутрикомплексных солей. В процессе титрования солей кальция и других металлов в присутствии мурексида в точке эквивалентности наблюдается изменение красного цвета раствора в сине-фиолетовый цвет. Структурную формулу мурексида можно представить следующим образом:
Уравнение электронейтральности раствора при титровании ЭДТА катионов. В процессе взаимодействия ЭДТА с катионами металлов протекают разнообразные реакции, обусловленные состоянием многих динамических равновесий, которые устанавливаются между ионами водорода, гидроксила, анионами ЭДТА, комплексонатов определяемого катиона и самого катиона металла, анионами анализируемой соли и ионами натрия.
Уравнение электронейтральности раствора можно представить следующим образом:
[H+] + [Na+I + 2[Me2+] = [ОН ‑] + [An ‑] + [H3Y ‑] + 2[H2Y2 ‑] + 2[MeY2 ‑] + 3[НY3 ‑] + 4[Y4 ‑]
Взаимодействие катионов металла с комплексоном, рассмотренное в § 26, отражает заключительную стадию титрования. На самом деле реакции титрования комплексоном более сложны. Доказано, что взаимодействие катионов металлов в степени окисления 2+ с ЭДТА протекает с образованием не только комплексов средней соли состава MeY2 ‑, но и кислых (протонированных) форм комплекса состава MeHY ‑;
Ме2+ + H2Y2 ‑ ⇄ MeY2 ‑ + 2Н+ (а)
Ме2+ + H2Y2 ‑ ⇄MeHY ‑ + Н+ (б)
Как видно из уравнения электронейтральности, при всех прочих равных условиях, содержимое Ме2‑ в растворе в значительной степени зависит от рН среды.
Условия комплексонометрического титрования. Основным условием комплексонометрического титрования является требование, предъявляемое к реакции, которая должна протекать таким образом, чтобы в точке эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости таких комплексов должна быть очень незначительной. При этом определяемые катионы должны образовывать с металл-индикатором комплексы, отличающиеся меньшей прочностью, чем их комплексы с комплексоном.
Титрование ЭДТА проводится при строго определенных условиях, из которых наибольшее значение имеет соблюдение требуемого значения рН. титруемого раствора.
В сильно кислых растворах с рН < 3 образуются менее устойчивые кислые комплексные соединения. Комплексообразованию устойчивых комплексных соединений способствует повышение значения рН титруемого раствора. Однако в сильнощелочных растворах при рН >10 наблюдается образование комплексных оксосоединений или осадков гидроокисей определяемых компонентов. Следует также иметь в виду, что при образовании комплекса определяемого катиона с комплексоном освобождаются ионы водорода, рН раствора понижается. Поэтому, если титруемые растворы не защищены действием буферной смеси, рН. раствора может понизиться на несколько единиц и требуемые комплексные соединения не образуются. Чтобы поддержать рН раствора на заданном уровне, необходимо проводить титрование в буферных растворах, отвечающих определенному значению рН.
Концентрация свободных анионов Y4 ‑ в кислых растворах ЭДТА ничтожно мала. Числовые значения обратных логарифмов (рК) констант диссоциации H4Y приведены ниже:
H4Y ⇄ H+ + H3Y ‑ (pК = 2,0)
H3Y ‑ ⇄ H+ + H2Y2 ‑ (pК2 = 2,67)
H2Y2 ‑ ⇄ H+ + HY3 ‑ (рК3=6,16)
НY3 ‑ ⇄ H+ + Y4 ‑ (pК4 = 10,26)
Суммарная константа, являющаяся произведением отдельных констант, равняется 10 ‑21'09, что соответствует рК — 21,09. Эти данные говорят о том, что HY3 ‑ является очень слабой кислотой и поэтому 6 растворе H4Y концентрация Y4 ‑ очень мала.
Можно рассчитать [Y4 ‑], применив закон действия масс;
[H+]4[Y4 ‑] ╱ [H4Y] = KH4Y
[Y4 ‑] = KH4Y[H4Y] ╱ [H+]4
Это уравнение показывает, что [Y4 ‑] сильно зависит от концентрации ионов водорода. По мере увеличения [Н+] уменьшается [Y4 ‑].
Концентрация свободных Y4 ‑ иohob 0,1 н. раствора ЭДТА в 0,1 н. растворе хлористоводородной кислоты (рН=1) равна:
[Y4 ‑] = (10 ‑21,09 • 10 ‑1) ╱ (10 ‑1)4 = 10 ‑18,09 моль/л
Только катионы (Fe3+, In3+, Sc3+, ZrIV, ThIV), образующие очень прочные комплексы с комплексоном, титруются в кислой среде. Катионы, образующие менее прочные комплексы с комплексоном, не титруются в кислой среде и не мешают титрованию катионов, определяемых в кислом растворе.
Вот почему титрование большинства катионов обычно проводят в аммиачной буферной среде (NH3 + NH4Cl) при рН = 8—9. Во избежание образования осадков гидроокисей и с целью маскировки отдельных катионов наряду с буферными смесями добавляют вспомогательные комплексообразующие вещества: тартраты или цитраты для Mn2+, Pb2+, In3+; тайрон (динатриевая соль 1,2-диоксибензол-3,5-дисульфокислоты) или фторид натрия для Ве2+, Al3+, TiIV; цианид калия для Zn2+, Cu2+, Cd2+ и т. д. Благодаря этому удается успешно проводить комплексонометрическое титрование большинства катионов и косвенным путем анионов.
Дата добавления: 2021-01-26; просмотров: 730;











