Электрохимическая коррозия
Электрохимическая коррозия металлических изделий происходит в различных водных растворах, проводящих электрический ток. Это наиболее распространенный тип коррозии. Она совершается в атмосферных условиях, на море, в земле, в грунтовых водах, в растворах кислот и щелочей, в почве.
Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала Е0, (В). Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах. Так, свинец растворяется значительно медленнее, чем железо.
Значения электродного потенциала Е0 разных элементов приведены в табл. 1.
Таблица 1.
Значения электродного потенциала разных элементов
| Элемент | Е0, (В) | Элемент | Е0, (В) |
| Mg | - 2,37 | Sn | -0, 14 |
| Al | - 1,66 | Pb | - 0,13 |
| Zn | - 0,76 | H | |
| Cr | - 0,74 | Cu | 0,34 |
| Fe | - 0,44 | Hg | 0,79 |
| Co | - 0,28 | Ag | 0,80 |
| Ni | - 0,25 | Au | 1,50 |
Разные фазовые составляющие, присутствующие в структуре сплава, находясь в электролите, приобретают разные по величине и знаку электродные потенциалы. Чем больше различие в электродных потенциалах отдельных фазовых составляющих, тем активнее будут протекать коррозионный процесс и коррозионное разрушение сплава. Электрохимическая гетерогенность поверхности металла является причиной коррозии. Более коррозионностойкими являются сплавы со структурой однородного твердого раствора.
Однако даже в случае однородной структуры коррозия может развиваться за счет образования анодных областей из-за наличия межкристаллитной пористости, остаточных напряжений в отдельных зернах и других факторов.
Особенно сильно электрохимическая коррозия развивается в случае контакта в конструкции разнородных материалов с разными потенциалами (например, коррозия стальных деталей в контакте с медными или магниевых сплавов в контакте со сталью).
При электрическом контакте двух металлов, обладающих разными электродными (электрохимическими) потенциалами и сходящихся в электролите, образуется гальванический элемент. Поведение металлов зависит от значения их электродного потенциала. Металл, имеющий более отрицательный электродный потенциал (анод), отдает положительно заряженные ионы в раствор и растворяется. Избыточные электроны перетекают по внешней цепи в металл, имеющий более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него удаляются во внешнюю среду. Чем ниже электродный потенциал металла по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл отдает ионы в раствор, тем ниже его коррозионная стойкость.
Иллюстрацией могут служить две стальные пластинки, одна из которых покрыта оловом, а другая цинком (рис. 1.).
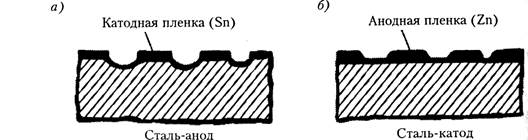
Рис. 1. Схема коррозии защитных покрытий:
а – катодного; б – анодного
Нарушение образующихся пленок приводит к тому, что из-за разности электродных потенциалов железо в пластинке с оловом становится анодом, а в пластинке с цинком, наоборот, катодом. Цинк, разрушаясь, защищает железо от коррозии. Этим объясняется долговечность строительной жести, домашних ведер, оцинкованных кузовных листов и др.
Контрольные вопросы:
1. Что такое коррозия?
2. В каких конструкционных материалах могут протекать процессы коррозии?
3. В чем особенность эксплуатации сельскохозяйственной техники, вызывающая ее коррозионное разрушение?
4. Какие затраты входят в прямой ущерб, причиняемый коррозией?
5. Какие затраты входят в косвенный ущерб, причиняемый коррозией?
6. Какие детали и узлы сельскохозяйственной техники корродируют только во время работы?
7. Какие конструкционные материалы и детали сельскохозяйственной техники разрушаются прежде всего при хранении техники на открытых площадках?
8. Назовите агрессивные среды, влияющие на коррозию сельскохозяйственной техники.
9. Какие противокоррозионные средства применяются в сельскохозяйственном производстве?
10. Перечислите методы воздействия на коррозионную среду (с целью уменьшения скорости коррозионных процессов), применяемые в сельском хозяйстве.
11. Перечислите методы воздействия на металл (с целью уменьшения скорости коррозионных процессов), применяемые в сельском хозяйстве.
12. На какие типы разделяют коррозию по механизму процесса?
13. Что такое химическая коррозия?
14. В каких средах может протекать химическая коррозия?
15. Назовите примеры газов и жидкостей, в которых может протекать химическая коррозия.
16. Что из себя представляют продукты химической коррозии?
17. В каком случае происходит пассивация металла при химической коррозии?
18. На каких металлах при протекании химической коррозии образуются плотные окисные пленки?
19. Что такое углеродистая сталь?
20. Что такое легированная сталь?
21. Что такое жаропрочность?
22. Что такое жаростойкость?
23. Какие стали относят к жаропрочным?
24. Какие стали относят к жаростойким?
25. В каких средах протекает электрохимическая коррозия металлических изделий?
26. Что такое нормальный электродный потенциал Е0?
27. Какой металл растворяется в электролите быстрее – алюминий или железо и почему?
28. Какой металл растворяется в электролите быстрее – цинк или медь и почему?
29. Как влияет на коррозионную стойкость количество фаз в сплаве?
30. Почему особенно сильно электрохимическая коррозия развивается в случае контакта в конструкции разнородных материалов с разными потенциалами?
31. Чем объясняется долговечность оцинкованных стальных изделий?
Дата добавления: 2016-10-07; просмотров: 3436;











