Практическое применение электрической проводимости.
1. Определение fэ сильных электролитов:
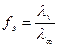
2. Определение константы и степени диссоциации слабых электролитов:
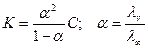
В не слишком разбавленных растворах величина a у слабых кислот и оснований очень мала, и можно считать, что 1 - a » 1. Тогда получаем:
K = a2 C и a = 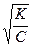
Это уравнение дает простой способ подсчета степени электролитической диссоциации слабого электролита в растворе данной концентрации, когда константа К известна.
 3. Определение солесодержания в растворе электролита:
3. Определение солесодержания в растворе электролита:
 1000 = Сi (lk + la)
1000 = Сi (lk + la)
Сi = 1000 / 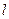 k +
k + 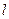 a
a
4. Определение растворимости труднорастворимых солей.
По закону действующих масс для бинарного электролита можно записать:
[K+] [A-] = K [KA] = ПР,
где ПР – произведение растворимости. ПР = const при Т = const
Если соединение диссоциирует нацело, то
 [K+] = [A-] = ÖПР = С (моль/л)
[K+] = [A-] = ÖПР = С (моль/л)
ПР и С определяют из данных насыщенного раствора электролита.
Пример: AgCl

 Сначала измеряют дистиллированной воды ( =1,5×10-6См/м).
Сначала измеряют дистиллированной воды ( =1,5×10-6См/м).
 насыщенного раствора AgCl равна 2,75×10-6См/м.
насыщенного раствора AgCl равна 2,75×10-6См/м.
 Следовательно:
Следовательно:
(AgCl) = 2,75×10-6 - 1,5×10-6 = 1,25×10-6 См/м
Электролитические подвижности ионов Ag+ и Cl- равны соответственно 53,8 и 65,2, а молярная электрическая проводимость при бесконечном разбавлении:
l¥ = 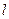 Ag +
Ag + 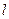 Cl = 53,5 + 65,2 = 119,0 См/м2
Cl = 53,5 + 65,2 = 119,0 См/м2
 Так как
Так как
l¥ = V;
то определяем V, содержащий 1 моль AgCl:
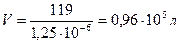
Число молей в 1 литре равно:
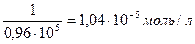
Дата добавления: 2016-09-26; просмотров: 2144;











