Енергетичні рівні молекул. Спектри молекул
 Молекула – найменша частинка речовини, що складається з однакових або різних атомів, з’єднаних між собою хімічними зв’язками, і яка є носієм хімічних і фізичних властивостей цієї речо-вини.
Молекула – найменша частинка речовини, що складається з однакових або різних атомів, з’єднаних між собою хімічними зв’язками, і яка є носієм хімічних і фізичних властивостей цієї речо-вини.
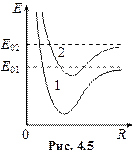
Власні значення енергії, що може набувати молекула, є залежними від відстані між ядрами R, тобто E=E(R). Енергія, зумовлена електронною конфігурацією (електронна енергія) має при деякому значенні R мінімум (рис. 4.5). Зміна електронної конфігурації молекули приводить до зміни кривої залежності електронної енергії від відстані між ядрами R.
В основному зміна енергетичного стану молекули відбувається внаслідок зміни в електронній конфігурації, що утворює периферійну частину молекули.
При заданій електронній конфігурації, ядра молекули можуть коливатися і обертатися навколо загального центра мас (рис. 4.6). З цими видами руху зв’язані коливальна і обертальна енергії.
Введемо такі позначення:
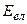 – енергія, зумовлена електронною конфігурацією (електронна енергія);
– енергія, зумовлена електронною конфігурацією (електронна енергія); 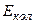 – енергія, що відповідає коливанням молекули (коливальна, або вібраційна енергія);
– енергія, що відповідає коливанням молекули (коливальна, або вібраційна енергія); 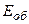 – енергія, зв’язана з обертанням молекули (обертальна енергія).
– енергія, зв’язана з обертанням молекули (обертальна енергія).
В першому наближенні рух електронів, коливання і обертання молекули – можна вважати незалежними один від одного. Тому повну енергію молекули можна подати у вигляді
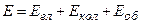 . (1.11)
. (1.11)
Відношення
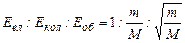 ,
,
 де m — маса електрона, М – величина порядку маси ядер атомів в молекулі,
де m — маса електрона, М – величина порядку маси ядер атомів в молекулі, 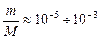 .
.
Тому
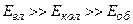 .
.
Доведено, що
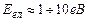 ,
, 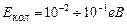 ,
, 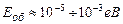 .
.
За правилом Бора частота 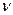 кванта, який випускає молекула при зміні її енергетичного стану, дорівнює
кванта, який випускає молекула при зміні її енергетичного стану, дорівнює
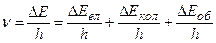 , (1.12)
, (1.12)
де 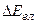 ,
, 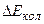 ,
, 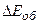 – зміни відповідних частин енергії молекули.
– зміни відповідних частин енергії молекули.
Оскільки кожний з доданків 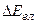 ,
, 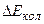 ,
, 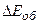 набуває ряду дискретних квантованих значень, то їх зміни також дають дискретні значення, тому спектр молекули складається з густо розміщених ліній, які утворюють смуги.
набуває ряду дискретних квантованих значень, то їх зміни також дають дискретні значення, тому спектр молекули складається з густо розміщених ліній, які утворюють смуги.
Енергію коливального руху описує вираз
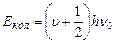
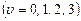 , (1.13)
, (1.13)
де 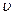 – коливальне квантове число, яке визначає величину коливального енергетичного рівня;
– коливальне квантове число, яке визначає величину коливального енергетичного рівня; 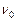 – власна частота коливань ядер атомів відносно положень їх рівноваги і
– власна частота коливань ядер атомів відносно положень їх рівноваги і
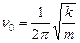 ,
,
де 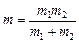 – зведена маса двохатомної молекули,
– зведена маса двохатомної молекули, 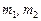 – маси атомів у молекулі, а
– маси атомів у молекулі, а 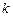 – силова стала, яка характеризує квазіпружні сили, які виникають в молекулі при відхилені ядер від положення рівноваги.
– силова стала, яка характеризує квазіпружні сили, які виникають в молекулі при відхилені ядер від положення рівноваги.
Момент імпульсу 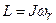 молекули може набувати тільки дискретні значення:
молекули може набувати тільки дискретні значення:
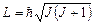
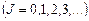 , (.14)
, (.14)
де J – обертальне квантове число, яке визначає обертальний енергетичний рівень.
Отже, обертальна енергія молекули може мати лише квантові значення:
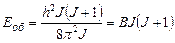 ,
,
де 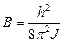 – обертальна стала молекули.
– обертальна стала молекули.
Дослід і теорія показують, що відстані між електронними рівнями 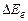 значно більші ніж відстані між коливальними рівнями
значно більші ніж відстані між коливальними рівнями 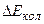 , які в свою чергу значно більші, ніж відстані між обертальними рівнями
, які в свою чергу значно більші, ніж відстані між обертальними рівнями 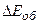 . Схема енергетичних рівнів двоатомної молекули виглядає так, як показано на рис.4.7.
. Схема енергетичних рівнів двоатомної молекули виглядає так, як показано на рис.4.7.
З кожним електронним енергетичним рівнем зв’язані коливальні рівні, з коливальним − обертальні рівні.
Будова молекул і властивості їх енергетичних рівнів проявляються в молекулярних спектрах – спектрах випромінювання (поглинання), що виникають при квантових переходах молекули на різні енергетичні рівні. Спектр випромінювання молекули визначається структурою її енергетичних рівнів і відповідними правилами відбору.
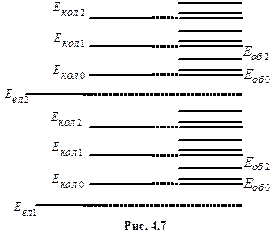 При різних типах переходів між рівнями виникають різні типи молекулярних спектрів. Якщо спостерігати спектр випромінювання–поглинання в тому діапазоні, який відповідає частоті
При різних типах переходів між рівнями виникають різні типи молекулярних спектрів. Якщо спостерігати спектр випромінювання–поглинання в тому діапазоні, який відповідає частоті 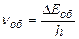 , то з’являтимуться тільки переходи між обертальними рівнями. Особливо ефективним інструментом дослідження в далекій інфрачервоній області є спектр поглинання.
, то з’являтимуться тільки переходи між обертальними рівнями. Особливо ефективним інструментом дослідження в далекій інфрачервоній області є спектр поглинання.
Якщо довжина хвилі 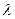 пучка променів настільки велика, що енергії фотонів
пучка променів настільки велика, що енергії фотонів 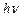 не вистачає для переведення молекули з одного обертального рівня на інший, то поглинання не буде. Поступове збільшення частоти падаючих променів приведе до того, що окремі фотони будуть поглинатися молекулами, які переходитимуть при тому на що раз вищі обертальні рівні. В цьому випадку виникає суто обертальний спектр поглинання. Він лежить в області мікрохвиль
не вистачає для переведення молекули з одного обертального рівня на інший, то поглинання не буде. Поступове збільшення частоти падаючих променів приведе до того, що окремі фотони будуть поглинатися молекулами, які переходитимуть при тому на що раз вищі обертальні рівні. В цьому випадку виникає суто обертальний спектр поглинання. Він лежить в області мікрохвиль 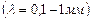 або, інакше, в діапазоні далекого інфрачервоного спектра.
або, інакше, в діапазоні далекого інфрачервоного спектра.
Коливально – обертальний спектр лежить в інфрачервоній області 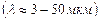 . Переходові між заданою парою коливальних рівнів відповідає велика сукупність комбінацій різних обертальних станів, які дають багато дуже близько розташованих ліній. Так виникає одна смуга. Лінії в смузі розташовані симетрично відносно
. Переходові між заданою парою коливальних рівнів відповідає велика сукупність комбінацій різних обертальних станів, які дають багато дуже близько розташованих ліній. Так виникає одна смуга. Лінії в смузі розташовані симетрично відносно 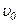 ліній і знаходяться на відстані одна від одної на
ліній і знаходяться на відстані одна від одної на 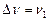 . Лише в середині смуги відстань в два рази більша, оскільки лінії з частотою
. Лише в середині смуги відстань в два рази більша, оскільки лінії з частотою 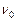 не виникає, тому що вона відповідає „забороненому” переходу
не виникає, тому що вона відповідає „забороненому” переходу 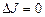 . Різним парам коливальних рівнів відповідають різні смуги, які у своїй сукупності утворюють коливально–обертальний спектр, що має вигляд групи смуг.
. Різним парам коливальних рівнів відповідають різні смуги, які у своїй сукупності утворюють коливально–обертальний спектр, що має вигляд групи смуг.
Продовжимо далі збільшувати частоту променів. Досягаючи видимої та ультрафіолетової частини спектра, отримуємо фотони, енергія яких є достатньою для збудження не тільки коливальних та обертальних процесів, але й електронних рівнів. З’являються електронно–коливально–обертальні переходи, при яких змінюються всі три види енергії молекули. Відповідний спектр називають електронно–коливально–обертальним або просто електронним. Переходові між заданою парою електронних рівнів відповідає цілий коливально–обертальний спектр молекули, тобто певна група смуг. Перебираючи всі можливі комбінації електронних рівнів, одержимо повний спектр молекули, тобто набір груп смуг.
Отже, в оптичному діапазоні молекулярні спектри є смугастими – вони складаються з величезного числа ліній, що утворюють ряд дуже густих скупчень смуг.
Структура молекулярних спектрів неоднакова для різних молекул і зі збільшенням числа станів у молекулі ускладнюється.
Дата добавления: 2020-12-11; просмотров: 538;











