Макроскопические величины.
Температура Т, давление р и объём V – макроскопические величины, характеризующие состояние огромного числа молекул, т.е. состояние газа в целом . Давление р. Молекулы газа непрерывно хаотически движутся, сталкиваются со стенками сосуда и передают им свой импульс p=mv. Давление – суммарный импульс, переданный молекулами 1 кв. м стенки за 1с. Объём V. Силы притяжения между молекулами газа малы, поэтому газ занимает весь предоставленный ему обьём. Температура Т. Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором не происходит теплопередачи от одного тела к другому, и все макроскопические параметры тел остаются неизменными. Температура – это физический параметр, одинаковый для всех тел, находящихся в тепловом равновесии. С понижением температуры скорость молекул и давление газа уменьшаются и , наконец, становятся равными нулю. Точа нулевого давления газа называется абсолютным нулём температурной шкалы Кельвина. В этой шкале единица измерения температуры такая же, как и в шкале Цельсия, но нулевая точка сдвинута: T= t +273.16. По шкале Цельсия абсолютный нуль равен -273.15. Температуры ниже этого значения не бывает! Да и сам абсолютный нуль в природе не достижим. 0˚С (по Цельсию) – это температура замерзания воды и таяния льда, а 100˚C - это температура кипения воды при нормальном атмосферном давлении.
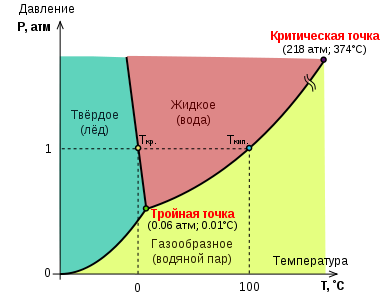 Тройна́я то́чка воды́ — строго определенные значения температуры и давления, при которых вода может одновременно и равновесно существовать в виде трёх фаз — в твердом, жидком и газообразном состояниях. Тройная точка воды — температура 273,16 К и давление 611,657 Па.
Тройна́я то́чка воды́ — строго определенные значения температуры и давления, при которых вода может одновременно и равновесно существовать в виде трёх фаз — в твердом, жидком и газообразном состояниях. Тройная точка воды — температура 273,16 К и давление 611,657 Па.
Идеальный газ – газ, состоящий из молекул-шариков, исчезающе малых размеров, взаимодействующих между собой и со стенками только во время упругих столкновений. Идеальный газ (модель)1. Совокупность большого числа молекул массой m0, размерами молекул пренебрегают (принимают молекулы за материальные точки) 2. Молекулы находятся на больших расстояниях друг от друга и движутся хаотически. 3. Молекулы взаимодействуют по законам упругих столкновений , силами притяжения между молекулами пренебрегают. 4. Скорости молекул разнообразны, но при определенной температуре средняя скорость молекул остается постоянной. Реальный газ 1. Молекулы реального газа не являются точечными образованиями, диаметры молекул лишь в десятки раз меньше расстояний между молекулами. 2. Молекулы не взаимодействуют по законам упругих столкновений
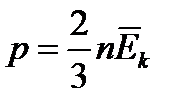
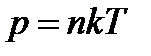 Основное уравнение молекулярно-кинетической теории. Давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема. n - концентрация молекул, k- постоянная Больцмана
Основное уравнение молекулярно-кинетической теории. Давление газа равно двум третям средней кинетической энергии поступательного движения молекул, содержащихся в единице объема. n - концентрация молекул, k- постоянная Больцмана
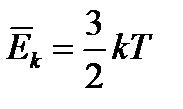 k = 1,38·10–23 Дж/К.
k = 1,38·10–23 Дж/К.
Дата добавления: 2016-09-26; просмотров: 2649;










