Переработка нитридного топлива на основе PUREX-процесса
Для обычных оксидных топлив реакторов LWR существует целый ряд возможных стратегий организации ядерного топливного цикла. Многие из них включают переработку на основе PUREX-процесса или другой технологии. В то время как вопрос о целесообразности переработки ОЯТ реакторов все еще обсуждается, стратегия ЯТЦ с быстрыми реакторами имеет смысл лишь в том случае, если предполагается рецикл топлива. Замкнутый ЯТЦ является главным условием использования реакторов-размножителей.
При использовании нитридного или какого-либо другого плотного топлива должны быть разработаны специальные методы их предварительной обработки, переводящие их в формы, сочетающиеся с обычной схемой переработки облученного топлива. Кроме того, образование в облученном нитридном топливе радиоактивного 14С по реакции (n,p) на ядрах 14N (его содержание в природном азоте превышает 99,6 %) может потребовать при производстве нитридного топлива азота, обогащенного по 15N.
Плотные топлива еще не перерабатывались в промышленном масштабе, хотя лабораторные эксперименты уже проводились. Причины этого очевидны: плотные топлива еще не облучались в реакторах в таких количествах, которые потребовали бы их переработку. Исключением является карбидное топливо.
Переработка плотных топлив, по-видимому, наиболее реальна при использовании PUREX-технологии. Для этого облученное нитридное топливо может быть предварительно окислено в атмосфере кислорода или углекислого газа, после чего полученные оксиды растворяются в азотной кислоте.
Использование нитридных топлив в ядерных реакторах имеет несколько преимуществ по сравнению с обычно используемыми оксидными топливами. Однако при промышленном использовании нитридного топлива нельзя пренебречь наработкой более 14 кг 14С на центральную зону реактора при возможном выгорании 20 %.
14С вероятно высвобождается в виде СО2 при переработке и его необходимо удержать с коэффициентом удержания около 1000; что можно сделать, например, осаждением в виде карбоната. Предполагается, что для крупномасштабного использования нитридных топлив время еще не пришло. Тем не менее, необходима общая оценка возможного топливного цикла с нитридным топливом до того, как такой цикл будет внедрен.
В качестве альтернативного использования азота естественного изотопного состава можно использовать топливо, обогащенное по 15N, что может снять проблемы с 14С. Однако современные цены на 15N (250 долларов за грамм) потребуют высокоэффективного рецикла этого изотопа при переработке.
В рамках оценки нитридного топливного цикла было предпринято исследование, чтобы получить информацию о распределении дорогого 15N при растворении топлива, а также улучшить понимание механизма процесса растворения.
Наиболее широко используемой во всем мире технологией переработки является PUREX-процесс, которому предшествует непосредственное растворение отработавшего топлива в азотной кислоте.
При растворении нитрида урана в растворе образуются UO 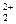 , NH
, NH 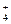 , NO
, NO 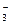 и HNO2, а в отходящих газах – N2, N2O и NO2 ↔ N2O4. Исследование основывается на работе, выполненной в Европейском институте трансурановых элементов, в которой исследована эволюция этих азотсодержащих соединений (кроме NO
и HNO2, а в отходящих газах – N2, N2O и NO2 ↔ N2O4. Исследование основывается на работе, выполненной в Европейском институте трансурановых элементов, в которой исследована эволюция этих азотсодержащих соединений (кроме NO 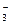 и нестабильного HNO2) в зависимости от времени при различных условиях растворения.
и нестабильного HNO2) в зависимости от времени при различных условиях растворения.
Таблетки нитрида урана были синтезированы гидридным методом. После гидрирования и дегидрирования металлического урана при ~ 300 ºС (с целью получения тонкого порошка металлического урана, уран был нитрирован при ~ 800 ºС. Затем порошок UN холодным прессованием переводился в таблетки, которые спекались при ~ 1700 ºС в атмосфере аргона, в результате чего получали таблетки UN с плотностью около 80 % от теоретической.
Использовались три различные процедуры растворения нитрида урана с варьированием двух параметров – концентрации кислоты и ее температуры:
- растворение таблеток, изготовленных из 15N2, в азотной кислоте, которая тоже была обогащена по 15N, с концентрацией 3 моль/л при 90 ºС. Это позволяет измерить отношение 15N/14N в синтезированных таблетках;
- растворение таблеток, обогащенных по 15N, в азотной кислоте с природным содержанием изотопов. Процесс растворения исследован здесь при двух температурах кислоты – 60 и 90 ºС и трех ее концентрациях – 3, 6 и 9 моль/л;
- растворение таблеток с природным содержанием азота в азотной кислоте, обогащенной по 15N. Этот вариант исследования позволяет подтвердить результаты ранее выполненных измерений для двух температур кислоты – 60 и 90 ºС и двух ее концентрациях – 3 и 6 моль/л.
В газовой фазе обнаружены N2, N2O, NO и NO2. Масс-спектры этих газов имеют несколько общих пиков и поэтому должны быть разделены для измерения изотопного состава.
Полученные результаты сведены в табл. 5.19.1 и 5.19.2. В табл. 5.19.1 приведены доли 15N в N2, N2O, NO и NН 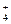 при различных концентрациях кислоты и температурах и различных отношениях 15N/ 14N, а в табл. 5.19.2 – распределения 15N в молекулах с двумя атомами азота – N2, и N2O.
при различных концентрациях кислоты и температурах и различных отношениях 15N/ 14N, а в табл. 5.19.2 – распределения 15N в молекулах с двумя атомами азота – N2, и N2O.
Несколько таблеток, обогащенных по 15N, сначала растворяли в HNO3, также обогащенной по 15N, чтобы измерить отношение 15N/14N в таблетках (см. табл. 5.19.1). Из содержания 15N в NH 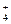 -ионе и сделан вывод о том, что синтезированные с 15N2 таблетки содержат около 85 % 15N.
-ионе и сделан вывод о том, что синтезированные с 15N2 таблетки содержат около 85 % 15N.
Растворение таблеток, обогащенных по 15N, в HNO3 природного изотопного состава дает следующие результаты:
- UN и NH 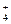 имеют одинаковый изотопный состав;
имеют одинаковый изотопный состав;
- N2 и N2O имеют смешанный изотопный состав;
- NO, NO2 и HNO3 имеют одинаковый изотопный состав.
Из табл. 5.19.1 и 5.19.2 (№№ 2-5) видно, что температура кислоты и ее концентрация мало влияют на изотопное отношение 15N/14N. Эти результаты подтверждаются растворением таблеток нитрида урана природного изотопного состава в HNO3, обогащенной по 15N.
С точки зрения механизмов, полученные результаты могут быть интерпретированы следующим образом: (азот поступает как из UN, так и из HNO3). Первой ступенью процесса может быть окисление до UO 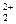 с образованием HNO2 и NH
с образованием HNO2 и NH 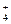 :
:
2UN+7{H++NO 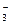 }+2H++H2O → 2{UO
}+2H++H2O → 2{UO 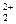 , 2NO
, 2NO 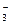 }+2NH
}+2NH 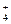 +3HNO2. (5.19.1)*)
+3HNO2. (5.19.1)*)
HNO2 катализирует растворение: она реагирует с HNO3 или диспропорционирует с образованием NO.
UN+2{H++NO 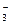 }+3HNO2+ H+ → {UO
}+3HNO2+ H+ → {UO 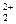 , 2NO
, 2NO 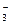 }+NH
}+NH 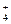 +H2O+3NO, (5.19.2)
+H2O+3NO, (5.19.2)
3HNO2 → {H++NO 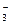 }+H2O+2NO. (5.19.3)
}+H2O+2NO. (5.19.3)
HNO2 также реагирует с HNO3 с образованием NO2:
{H++NO 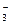 }+HNO2 → H2O+{2NO2↔N2O4}. (5.19.4)
}+HNO2 → H2O+{2NO2↔N2O4}. (5.19.4)
HNO2 или HNO3 реагируют с 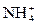 с образованием молекул с двумя атомами азота:
с образованием молекул с двумя атомами азота:
NH 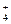 +HNO3 → H++2H2O+(NNO)N2O, (5.19.5)
+HNO3 → H++2H2O+(NNO)N2O, (5.19.5)
или NH 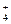 +HNO2 → H++2H2O+(NNO)N2. (5.19.6)
+HNO2 → H++2H2O+(NNO)N2. (5.19.6)
Нельзя забывать и о вторичной реакции NO с HNO3 с образованием NO2:
2{H++NO 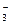 }+2NO → 2HNO2+{2NO2↔N2O4}. (5.19.7)
}+2NO → 2HNO2+{2NO2↔N2O4}. (5.19.7)
Здесь рассматриваются химические аспекты растворения нитридного топлива, и представленные результаты по обменным реакциям оказывают существенное влияние на использование 15N при изготовлении топлива. Как следует из реакций (5.19.1) и (5.19.2) катионы аммония образуются лишь из азота нитридного топлива. В эти ионы переходит около 15 % азота нитридного топлива.
Поэтому не будет возможности рециклировать 15N полностью, хотя использование для растворения азотной кислоты, также обогащенной по 15N, могло бы помочь, однако стоимость этого метода может стать неприемлемой.
Таблица 5.19.1
Процентное содержание 15N в разных молекулах при растворении UN в HNO3 при различных условиях
| № | Температура, ºС | Концентрация, моль/л | Соединение | ||||||
| UN | NH 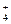
| N2 | N2O | NO | NO2 | HNO3 | |||
| Первый тип растворения | |||||||||
| 85,2 | 62,6 | 89,3 | 96,2 | 93,0 | 99,5 | ||||
| Второй тип растворения | |||||||||
| 85,2 | 83,7 | 29,9 | 39,6 | 0,5 | 2,5 | 0,4 | |||
| 85,2 | 83,9 | 38,2 | 37,6 | 0,6 | 1,1 | 0,4 | |||
| 85,2 | 82,7 | 33,0 | 38,4 | 0,5 | 1,6 | 0,4 | |||
| 85,2 | 83,9 | 40,5 | 38,2 | 0,8 | 0,8 | 0,4 | |||
| Третий тип растворения | |||||||||
| 0,4 | 0,4 | 35,8 | 49,1 | 95,8 | 96,2 | 99,7 | |||
| 0,4 | 0,4 | 40,5 | 49,1 | 95,4 | 96,8 | 99,7 | |||
| 0,4 | 0,4 | 36,1 | 49,3 | 96,6 | 97,3 | 99,7 |
Таблица 5.19.2
Изотопный состав азота в N2 и N2O при растворении UN в HNO3 при различных условиях
| № | Температура, ºС | Концентрация, моль/л | N2 | N2O | ||||
| 14N - 14N, % | 14N - 15N, % | 15N - 15N, % | 14N - 14N, % | 14N - 15N, % | 15N - 15N, % | |||
| Первый тип растворения | ||||||||
| 30,4 | 55,6 | 0,4 | 20,7 | 78,9 | ||||
| Второй тип растворения | ||||||||
| 43,2 | 53,8 | 3,0 | 21,3 | 78,3 | 0,4 | |||
| 27,9 | 67,9 | 4,2 | 25,3 | 74,2 | 0,5 | |||
| 37,4 | 59,3 | 3,3 | 23,8 | 75,8 | 0,4 | |||
| 25,2 | 68,8 | 6,0 | 24,3 | 75,1 | 0,6 | |||
| Третий тип растворения | ||||||||
| 29,0 | 70,7 | 0,4 | 2,7 | 96,5 | 0,8 | |||
| 20,0 | 79,5 | 2,7 | 96,5 | 0,8 | ||||
| 28,3 | 71,3 | 0,4 | 2,1 | 97,2 | 0,7 |
Рассмотренные механизмы растворения нитридного топлива показывают, что единственным способом выделения дорогого 15N при переработке UN является рециклирование NH  -иона, что может оказаться очень трудным.
-иона, что может оказаться очень трудным.
С другой стороны, современная цена 15N нереалистично высока из-за малого спроса на него. Если топливный цикл на основе 15N будет разработан и внедрен, потребность в 15N составит около 1,6 тонн на активную зону и рыночные силы, вероятно, снизят его цену, по меньшей мере, в 100 раз.
Другой возможностью подготовки топлива к растворению является использование процесса волоксидации, переводящего нитриды в оксиды до их растворения, и позволяющие выделить 15N из топлива прежде, чем оно будет контактировать с азотной кислотой, содержащей 14N.
Волоксидация, то есть окисление при температуре 450-600 ºС считается желательной предварительной операцией при переработке нитридного топлива в случае использования PUREX-технологии. В результате волоксидации из смешанного уран-плутониевого нитридного топлива образуется (U,Pu)O2 и N2. При реализации процесса волоксидации следует так подобрать условия окисления, чтобы избежать образования U3O8, так как оно сопровождается существенным обогащением смешанного оксида по плутонию, что будет иметь следствием уменьшение растворимости топлива в азотной кислоте. Возможно также окисление нитридного топлива в атмосфере СО2 при 800 ºС.
Проведены исследования непосредственного растворения плотных топлив, облученных до выгорания 8 % ат., перед подачей на переработку в PUREX-процесс. При этом сравнивалось поведение при растворении смешанного уран-плутониевого оксидного топлива с поведением смешанных уран-плутониевых карбидного и нитридного топлив. Установлено, что оксид урана растворяется существенно быстрее, чем оксид плутония. Это приводит к образованию обогащенных плутонием остатков, которые трудно или даже невозможно растворить в кипящей азотной кислоте. В то же время нитриды плутония и урана растворяются в азотной кислоте с одинаковой скоростью. Эти эксперименты проводили в четырехмолярной азотной кислоте при 80 ºС для МО2 и 70 ºС для MN. Проведенные таким образом эксперименты свидетельствуют, что растворение в азотной кислоте с концентрацией от 4 до 12 моль/л вполне может быть головной операцией переработки смешанного уран-плутониевого нитридного топлива, облученного до выгорания 8 % ат. Доля нерастворившегося плутония при этом невелика и лежит в пределах от 0,11 до 0,68 %, а общая масса твердых остатков составляет 0,3-0,6 %. При этом значительную часть этих остатков составляет 106Ru. В остатках обнаруживается также некоторое количество 125Sb и незначительное количество 137Cs.
Отходящие газы при растворении нитридного топлива содержат NOx и некоторое количество N2. Состав газа зависит от температуры, концентрации азотной кислоты и времени, прошедшего после окончания растворения.
Для смешанного уран-плутониевого нитридного топлива предложены две схемы переработки в зависимости от того, будет или нет использоваться топливо обогащенное по 15N и будет ли он улавливаться.
Впервые возможность использования в нитридном топливе азота, обогащенного по 15N, была показана еще в 1969 г. в Ок-Риджской национальной лаборатории в США.
Для нитридного топлива с необогащенным по 15N азотом начальной ступенью переработки лучше всего было бы непосредственное растворение без предварительной волоксидации. Контролируемое окисление в СО2 можно не использовать, так как дополнительная ступень окисления приводит к образованию больших количеств СО и СО2, содержащих неразделимую смесь 12С и 14С. Волоксидация в О2 не приводит к образованию такой смеси и 14СО2 может быть уловлен. Однако по сравнению с непосредственным растворением волоксидация требует добавочной ступени обработки.
Поведение углерода в процессе непосредственного растворения детально еще не изучено. В топливе содержится как 14С, образовавшийся при нейтронном облучении природного азота, так и примеси 12С, попавшие в топливо при его изготовлении. При окислительных условиях в аппарате-растворителе углерод, вероятнее всего, перейдет в СО2 и попадет в систему газоочистки. Нельзя, однако, исключить возможность частичного удержания элементного углерода нерастворившимися остатками топлива. Поэтому еще предстоит исследовать распределение 14С между различными фазами, образовавшимися в процессе растворения топлива, что поможет исключить расползание 14С по различным технологическим потокам при переработке.
При использовании нитридного топлива, обогащенного по 15N, становится почти неизбежным его предварительное окисление в газообразном кислороде. Выделяющийся при этом 15N может быть отделен от отходящих газов и рециклирован в топливо. Чтобы этот процесс был достаточно эффективным, отходящие газы, сопровождающие процесс волоксидации, должны быть отделены от газов аппарата-растворителя, в которых преобладают 14NOx. Если это условие не выполнено, то изотопный обмен между 15N2 и 14NOx приведет к трудностям при рециклировании 15N.
Схема начальных ступеней обработки нитридного топлива, совместимых с PUREX-технологией, приведена на рис. 5.19.1. Левая часть схемы – для случая нитридного топлива с азотом природного изотопного состава, а правая – для топлива, обогащенного по 15N.
В табл. 5.19.3 приведены доступные сведения о нитридном топливе в сравнении с оксидным.
 Существует несколько химических методов улавливания и отверждения СО2. Перспективным считают использование реакции:
Существует несколько химических методов улавливания и отверждения СО2. Перспективным считают использование реакции:
Са(ОН)2 + СО2 → СаСО3 + Н2О.
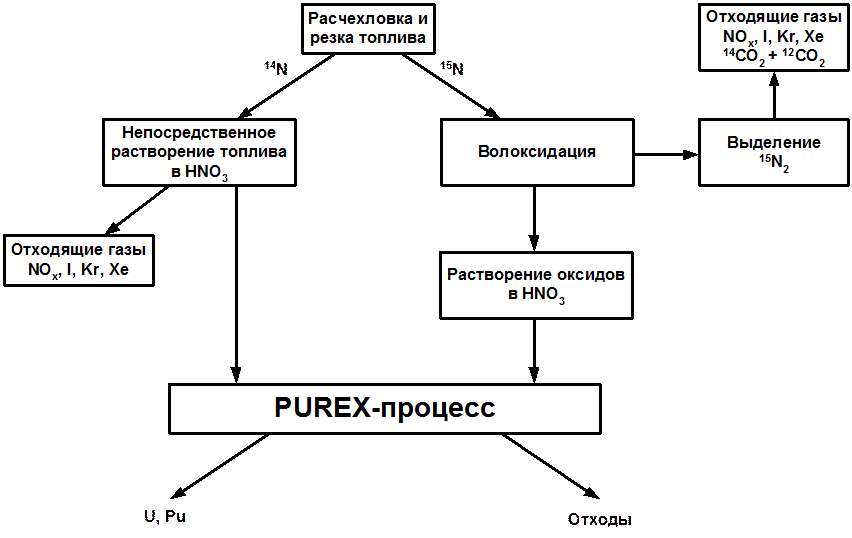 Рис. 5.19.1 Начальные этапы переработки уран-плутониевого нитридного топлива
Рис. 5.19.1 Начальные этапы переработки уран-плутониевого нитридного топлива
|
Таблица 5.19.3
Дата добавления: 2019-05-21; просмотров: 1438;











