Ван-дер-ваальсовские радиусы некоторых элементов
| Элемент | Ван-дер-ваальсовский радиус, пм | Элемент | Ван-дер-ваальсовский радиус, пм |
| H | S | ||
| F | N | ||
| Cl | P | ||
| Br | C | ||
| I | Si | ||
| O |
Эффективные ван-дер-ваальсовские радиусы могут быть приписаны не только отдельным атомам, но и их группам. Например, эффективный ван-дер-ваальсовский радиус метильной групп равен 200 пм.
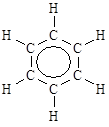
| 
| 
|
Рис. 3.8. Молекула бензола, представленная в виде ковалентных и ван-дер-ваальсовских радиусов атомов водорода и углерода
Из сравнения данных табл. 3.1 и 3.3 видно, что ван-дер-ваальсовские радиусы заметно больше ковалентных. Особенно хорошо это видно на рис. 3.8, на котором атомы в молекуле бензола представлены в виде сфер, отвечающих ковалентным и ван-дер-ваальсовским радиусам водорода и углерода.
Значения ван-дер-ваальсовских радиусов позволяют определить конформацию молекулярных частиц и их упаковку в кристаллах. Энергетически выгодными обычно являются такие конформации молекул, в которых перекрывание ван-дер-ваальсовских радиусов отсутствует или незначительно.
3.3. Взаимное влияние атомов в молекуле
v Индуктивный эффект. Наличие в молекуле полярной связи ведет к поляризации 2-3 ближайших углерод-углеродных s-связей. Такое смещение электронной плотности по цепи s-связей называют индуктивным (индукционным) эффектом. Различают положительный индуктивный эффект (обозначают +I) – отталкивание электронной плотности от атома или группы атомов, и отрицательный индуктивный эффект (обозначают -I) – оттягивание электронной плотности к атому или группе атомов. +I-эффект характерен для алкильных групп и металлов, -I-эффектом обладают электроноакцепторные атомы и группы (галогены, гидроксильная группа и т.д.). Индуктивный эффект водорода принимают за 0.
+I-эффект алкильных групп наиболее явно проявляется при действии на p-электронные системы, что связано с меньшей электроотрицательностью атома углерода в sp3-гибридном состоянии по сравнению с sp2- и sp-гибридизированными атомами углерода (подробнее см. Главу 9 «Алкины»).
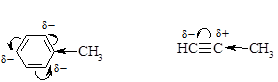
Максимальные индуктивные эффекты наблюдаются для атомов с целочисленными зарядами.
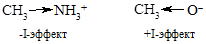
Индуктивный эффект быстро затухает по цепи (d’ > d” > d’”). Практически он исчезает на 3-4 атоме от рассматриваемой функции. Индуктивный эффект изображают с помощью прямой стрелки.
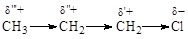
Т.к. p-электроны двойной и тройной связи более подвижны, то и поляризация происходит сильнее. В ниже приведенном ряду d < d < d”.
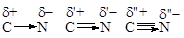
· Эффект поля. Различие в реакционной способности молекул не всегда удается объяснить исходя из концепции индуктивного эффекта. Было установлено, что в некоторых случаях действие заместителя оказывается не по ковалентным связям, а непосредственно через пространство. Такое явление назвали эффектом поля. В приведенных ниже кислотах атомы галогена отделяет от карбоксильной группы одинаковое количество ковалентных связей, но для второй кислоты атомы хлора расположены ближе и кислотность такой кислоты выше.
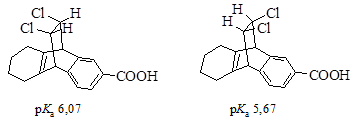
v Мезомерный эффект.
Ø Сопряжение (мезомерия) – перераспределение электронной плотности, приводящее к делокализации p-связей (молекулярная орбиталь охватывает более двух атомов).
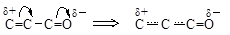
Мезомерный эффект показывают на схемах полукруглой стрелкой, идущей от середины связи к электроноакцепторному атому. Смещение электронных пар в результате сопряжения называют мезомерным эффектом. Аналогично индуктивному эффекту выделяют положительный (обозначают +М) и отрицательный (обозначают -М) мезомерный эффект, соответственно, подача или оттягивание электронной пары от атома или группы атомов. Например, в амидах аминогруппа обладает +М-эффектом, а атом кислорода – -М-эффектом.
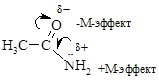
Различают p,p-сопряжение (в сопряжении участвуют две и более p-связей) и р,p-сопряжение (в сопряжении участвует p-связь и р-электроны, находящегося рядом атома).
| p,p-Сопряжение | р,p-Сопряжение |
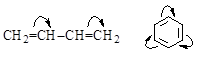 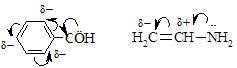
|
Электронные эффекты могут совпадать по направлению смещения электронной плотности или действовать в противоположных направлениях. Результирующее действие заместителей представлено ниже в таблице 3.4.
Таблица 3.4
Дата добавления: 2016-09-06; просмотров: 2370;











