Качественное определение элементов в органических молекулах
v Углерод и водород. Присутствие углерода и водорода можно всегда открыть, если прокаливать сухое вещество в смеси с измельченным оксидом меди или хроматом свинца, в результате чего углерод окисляется до углекислого газа, а водород до воды. Образование воды обнаруживают по появлению капель или по посинению безводного сульфата меди при его превращении в медный купорос, а выделение диоксида углерода подтверждают помутнением при пропускании образовавшихся газов через раствор гидроксида бария.
[C, H] + CuO 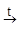 CO2 + H2O + Cu2O + Cu
CO2 + H2O + Cu2O + Cu
CuSO4 + H2O ® CuSO4×5 H2O
CO2 + Ba(OH)2 ® BaCO3¯
v Азот. Общепринятым для открытия азота является метод Лоссеня[8]. По этому способу сплавляют около 0,1 г органического вещества с натрием и сильно нагревают. Содержащийся в органическом веществе азот частично превращается в неорганические соли.
Na + [C, N] 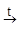 NaCN + NaOCN
NaCN + NaOCN
§ Качественными реакциями открывают цианид-анион. По классическому варианту расплав растворяют в воде, прибавляют небольшое количество соли двухвалентного железа. После подкисления раствора и добавления к нему хлорида железа(III) образуется синий осадок или, если раствор сильно разведен, появляется синее окрашивание раствора вследствие образования берлинской лазури.
2NaCN + FeSO4 → Na2SO4 + Fe(CN)2
Fe(CN)2 + 4NaCN → Na4[Fe(CN)6]
3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12 NaCl
§ Более точное определение азота дает реакция раствора, содержащего цианид-ион, с реакционной смесью растворов п-нитробензальдегида, о-динитробензола и гидроксида натрия. При наличии в соединении азота анализируемая смесь окрашивается в интенсивный пурпурно-синий цвет.
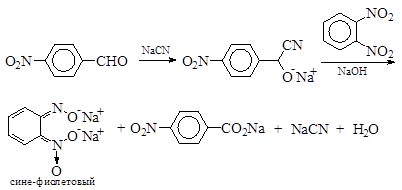
v Сера. В результате сплавления пробы вещества, содержащего серу, с натрием по Лоссеню образуется сульфид натрия, который открывают в растворе нитропруссидной реакцией (сине-фиолетовое окрашивание) или по реакции с солями свинца или меди(II) (черный осадок).
Na + [C, S] 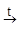 Na2S + C
Na2S + C
Na2S + Pb(OOCCH3)2 ® PbS¯ + 2CH3COONa
Na2S + Na2[Fe(CN)5(NO)] ® Na2[Fe(CN)5(NOS)]
§ Иначе можно провести разложение по Кариусу[9]. Вещество запаивают в ампулу с дымящей азотной кислотой, постепенно повышают температуру до 300-350 °С и оставляют на 3-5 часов. Органическое вещество сгорает, образуя воду и углекислый газ, а сера превращается в серную кислоту, которую определяют по образованию осадка сульфата бария.
HNO3 + [C, S] 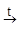 H2SO4 + CO2
H2SO4 + CO2
H2SO4 + BaCl2 ® BaSO4¯ + 2HCl
v Галогены. При определении элементов по Лоссеню, действуя на подкисленный раствор пробы раствором нитрата серебра, можно по образованию белого или желтоватого осадка открыть и галогены.
Na + [C, Hal] 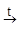 NaHal + C
NaHal + C
NaHal + AgNO3 ® AgHal¯ + NaNO3
§ Проба Бейльштейна[10]. Медную проволоку прокаливают в пламени горелки до тех пор, пока пламя не перестанет окрашиваться в зеленый цвет. После охлаждения на конец проволоки наносят капельку или кристаллик испытуемого вещества. При внесении в пламя горелки оно окрашивается в зеленый цвет за счет образования галогенидов меди.
RHal + CuO 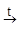 CuHal2 + Cu2Hal2
CuHal2 + Cu2Hal2
Зеленое окрашивание могут также вызывать некоторые азотсодержащие соединения.
Дата добавления: 2016-09-06; просмотров: 1800;











