ПРИРОДА ПОВЕРХНОСТНОЙ ЭНЕРГИИ
АДСОРБЦИЯ
Поверхностный слой, возникающий на границе раздела различных фаз, согласно Гиббсу, представляет собой промежуточную фазу толщиной всего в несколько молекулярных диаметров. В ряде случаев поверхностный слой имеет толщину, примерно равную диаметру молекулы, и в этом случае его называют мономолекулярным.
Поверхностными явлениями называют процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного слоя.
Молекулы, атомы, ионы, находящиеся на поверхности раздела фаз, не равноценны по своему положению таким же частицам, находящимся в глубине фазы. Удобно рассмотреть в качестве примера систему, состоящую из жидкости и газа.
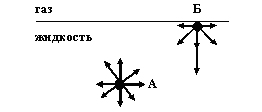
Рис. 1 Схема возникновения поверхностной энергии
Молекула А (рис 1.) внутри жидкости окружена со всех сторон другими молекулами. Силы взаимодействия при этом взаимно уравновешиваются, равнодействующая равна нулю. У поверхностных молекул силы, действующие со стороны жидкой и газообразной фаз, неодинаковы. Молекулярные взаимодействия в вертикальном направлении не уравновешены. Вследствие этого равнодействующая молекулярных сил не равна нулю и направлена вглубь жидкой фазы. Эту силу часто называют внутренним давлением.
Чем сильней различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды р = 14800 атм. Внутреннее давление стремится втянуть молекулу вглубь жидкости.
Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого надо совершить работу против внутреннего давления. Очевидно, что чем оно больше, тем больше энергии требуется затратить. Эта энергия сосредотачивается в молекулах, находящихся на поверхности, и называется свободной поверхностной энергией.
Свободная поверхностная энергия зависит от количества частиц на поверхности раздела, а потому прямо пропорциональна площади раздела фаз и удельной энергии межфазной поверхности.
F = σ · S при V, T – const
G = σ · S при p, T – const
где σ - удельная свободная поверхностная энергия, которая равна работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу. Она зависит от природы контактирующих фаз и температуры.
В зависимости от агрегатного состояния контактирующих фаз различают поверхностные явления для подвижной и неподвижной поверхности раздела. В системах газ-жидкость и жидкость-жидкость поверхность раздела подвижна, так как частицы поверхности раздела постоянно обновляются вследствие теплового движения молекул каждой фазы.
Удельную свободную поверхностную энергию для подвижных поверхностей раздела фаз называют коэффициентом поверхностного натяжения и обозначают σг/ж или σж/ж, где [σ] = Дж/м2 или (Н·м)/м2 = Н/м.
Существуют различные методы экспериментального определения поверхностного натяжения σ. Например:
1. Метод наибольшего давления образования пузырька,в котором измеряется давление, при котором пузырек газа проскакивает через воду (р0), а затем через исследуемую жидкость (рх). 
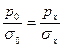
2. Метод капиллярного поднятия. В нём измеряется высота h, на которую поднимается жидкость плотностью d по капилляру радиусом r.
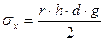
3. Сталагмометрический метод (метод счета капель). Подсчитывается число капель воды n0, а затем исследуемой жидкости nх, которые вытекают из одного и того же объема сталагмометра



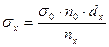
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий соприкасающихся фаз. Чем больше эти различия, тем больше σ. Для границы жидкость – воздух можно пренебречь межмолекулярными взаимодействиями в воздухе, и, значит, поверхностное натяжение характеризует интенсивность межмолекулярных сил в конденсированной фазе. В таблице 1 приведены значения σ некоторых веществ в жидком состоянии на границе с воздухом.
Таблица 1 Поверхностное натяжение на границе с воздухом (t = 200С)
| Жидкость | σ, мДж/м2 |
| Ртуть | |
| Вода | 72,75 |
| Глицерин | |
| Анилин | 42,9 |
| Бензол | 28,9 |
| Этиловый спирт | 21,6 |
Поверхностное натяжение у различных жидкостей колеблется в значительных пределах (для полярных жидкостей σ больше, чем для неполярных) и зависит от температуры, давления, а для растворов и от концентрации растворенных веществ.
Поверхностное натяжение биологических жидкостей используется в диагностических целях. Так, поверхностное натяжение плазмы крови подвержено значительным колебаниям при различных заболеваниях. С возрастом человека поверхностное натяжение сыворотки крови уменьшается. Поверхностное натяжение играет значительную роль в таких явлениях как деление клеток, фагоцитоз, пиноцитоз, изменение проницаемости клеточных мембран и др.
В системах газ - твердое тело или жидкость - твердое тело поверхность раздела неподвижна. Удельную свободную поверхностную энергию (σг/тв, σж/тв) экспериментально определить трудно, но её значение можно оценить по способности твердой поверхности к смачиванию.
Свободная поверхностная энергия при постоянном давлении совпадает с термодинамической функцией - энергией Гиббса, характеризующей состояние поверхности раздела фаз в гетерогенных системах. В соответствии со вторым законом термодинамики, все самопроизвольные процессы происходят в направлении, приводящем к уменьшению энергии Гиббса, поэтому и все поверхностные явления самопроизвольно протекают только в тех случаях, когда свободная поверхностная энергия системы уменьшается (∆G < 0).
Поскольку свободная поверхностная энергия зависит от двух параметров - σ и S, то и все поверхностные явления совершаются самопроизвольно, если при этом снижается удельная свободная поверхностная энергия (∆σ < 0) или уменьшается площадь поверхности раздела фаз (∆S < 0), или происходит такое изменение этих величин, чтобы ∆G = ∆σ · ∆S < 0.
К самопроизвольным поверхностным явлениям, которые сопровождаются уменьшением G за счет уменьшения площади поверхности, относятся:
Коалесценция - слияние капель жидкости или пузырьков газа.
Коагуляция- слипание частиц в дисперсных системах.
К самопроизвольным поверхностным явлениям, сопровождающимся уменьшением G за счет снижения удельной свободной поверхностной энергии σ, относится сорбцияи её последствия: смачивание, эмульгирование и др.
СОРБЦИЯ И ЕЁ ВИДЫ
Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями носят общее название сорбции. Если сорбция идет только на поверхности, то её называют адсорбцией.Она приводит к увеличению концентрации вещества на границе раздела фаз. Если поглощаемое вещество диффундирует вглубь поглотителя, то явление называется абсорбцией. То вещество, на поверхности которого идет адсорбция, называется адсорбентом, а которое адсорбируется - адсорбатом (адсорбтивом). Адсорбцию Г обычно выражают соотношением количества адсорбата X, приходящегося на единицу площади адсорбента S (кмоль/м2)
Г = X / S
Если адсорбентом является твердое пористое тело, общую поверхность которого определить невозможно, то величину адсорбции Г относят к единице массы адсорбента m (кмоль/кг)
Г = X / m
Между адсорбентом и адсорбатом возникают адсорбционные силы. В зависимости от их природы рассматривают два крайних случая: физическуюи химическуюадсорбцию.
Физическая адсорбциявозникает за счет Ван-дер-Ваальсовых взаимодействий. Она характеризуется
1) Обратимостью, т.е. может протекать обратный процесс - десорбция. Скорость адсорбции с течением времени уменьшается, а скорость десорбции увеличивается, что приводит к адсорбционному равновесию
адсорбция ↔ десорбция,
при котором скорости двух противоположных процессов становятся одинаковыми.
2) При повышении температуры величина адсорбции уменьшается, так как увеличивается скорость десорбции.
3) Малой специфичностью.
4) При физической адсорбции могут иметь место как нелокализованная адсорбция, когда молекулы адсорбата способны передвигаться по поверхности адсорбента, так и локализованная адсорбция.
С физической адсорбцией связаны стабилизация дисперсных систем, стирка, ощущение вкуса, запаха и др.
Химическая адсорбция (хемосорбция)является химическим процессом, поэтому
1) Необратима.
2) С повышением температуры увеличивается.
3) Специфична. Адсорбция происходит, если возможна химическая реакция.
4) Молекулы адсорбата связаны с адсорбентом прочными химическими силами и не могут перемещаться по поверхности последнего, поэтому химическая адсорбция - локализованная.
Примером является адсорбция кислорода на алюминии, приводящая к образованию поверхностной оксидной пленки.
Уравнение адсорбции устанавливает функциональную связь величины адсорбции с равновесной концентрацией и температурой Г = f (С, Т), если адсорбция идет из растворов, и равновесным давлением и температурой Г = f (Р, Т), если адсорбируется газ.
При постоянной температуре адсорбированное количество вещества есть функция равновесной концентрации Г = f (С)т или равновесного давления Г = f (Р)т.
Графическая зависимость называется изотермой адсорбции и имеет вид кривой, на которой можно выделить три участка: I и III - прямолинейные, II - криволинейный.
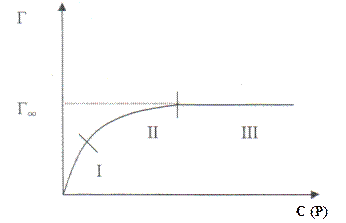
Рис. 2 Изотерма мономолекулярной адсорбции
Дата добавления: 2016-08-23; просмотров: 3323;











