Фазовые переходы в нефти, воде и газе
Фазовые переходы подчиняются определённым закономерностям, в основе которых лежит понятие равновесия фаз. Равновесие фаз характеризуется константой равновесия, которая зависит от температуры и давления.
Константа фазового равновесия i-го компонента характеризуется отношением мольной доли компонента в газовой фазе (Nyi) к мольной доле этого компонента в жидкой фазе (Nxi), находящейся в равновесном состоянии с газовой фазой:
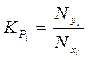 . (4.1)
. (4.1)
Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля.
Согласно закону Дальтона, каждый компонент, входящий в газовую фазу, имеет своё парциальное давление (рi), а общее давление (Р) в газовой системе равно сумме парциальных давлений:
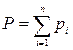 , pi = Nуi ×Р, (4.2)
, pi = Nуi ×Р, (4.2)
где pi – парциальное давление i-го компонента в газовой фазе;
Nуi – мольная доля i-го газового компонента.
Согласно закону Рауля, парциальное давление компонента (pi) над жидкостью равно давлению насыщенного пара (Рi пара нас) i-го компонента или его упругости пара (Qi), умноженному на его мольную долю (Nxi) в жидкости:
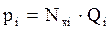 ,
, 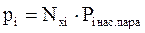 , (4.3)
, (4.3)
где Qi – упругость паров i-го компонента;
Nxi – мольная доля i-го компонента в жидкости;
Рi нас пара– давление насыщенного пара i-го компонента.
В момент равновесия парциальное давление i-го компонента в газовой фазе равно парциальному давлению компонента над жидкостью. И это равновесное состояние двухфазной системы (газовой и нефтяной фаз) описывается законом Дальтона–Рауля:
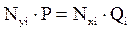 . (4.4)
. (4.4)
Уравнение (4.4), описывающее равновесное состояние двухфазной системы, позволяет рассчитать состав равновесной газовой фазы для известного состава жидкой фазы и наоборот – найти равновесный состав жидкой фазы для известного состава газовой фазы и находящейся с ней в контакте.
Рассмотрим пример. Известен мольный состав (в долях) жидкой фазы: С3Н8 – 0,2; i-C4H10 – 0,3; n-C4H10 – 0,5. Температура смеси 25 °С. Давления насыщенных паров (упругости паров) углеводородов взяты из справочных данных:
QС3Н8 – 0,92 МПа, Qi-С4Н10 – 0,37 МПа, Qn-С4Н10 – 0,28 МПа.
Найти состав равновесной газовой фазы.
Решение. Определяем общее давление в системе (МПа):
Р = S(Nxi ·Qi) = 0,2·0,92 + 0,3·0,37 + 0,5·0,28 =
0,184 + 0,111 + 0,14 = 0,435
Воспользуемся соотношением (4.4) и рассчитываем мольные доли компонентов газовой фазы:
Nyi = Nxi ·Qi/Р → NС3Н8 = 0,2·0,92/0,435 = 0,184/0,435 = 0,423;
Ni-С4Н10 = 0,3·0,37/0,435 = 0,111/0,435 = 0,255;
Nn-С4Н10 = 0,5·0,28/0,435 =0,14/0,435 = 0,332;
SNyi = 0,423 + 0,255 + 0,332 = 1.
Уравнения
Р = S(Nxi ·Qi), Р = S(Nxi ·Рi пара нас) (4.5)
называются уравнениями начала однократного(контактного) испарения. Они характеризуют то давление, при котором смесь кипит при данной температуре. Температура учитывается в этом уравнении в неявном виде, так как упругости паров (давление насыщенных паров) компонентов зависят от температуры.
Рассмотрим пример. Известен объёмный состав (Vi, доли) газовой фазы: C3H8 – 0,6; i-C4H10 – 0,3; n-C4H10 – 0,10. Температура смеси 25 °С.
Найти состав компонентов равновесной жидкой фазы.
Решение. Зная, что Vi = Ni, а упругости паров компонентов (Qi) взятые из справочных данных, равны: QС3Н8 – 0,92 МПа, Qi-С4Н10 – 0,37 МПа,
Qn-С4Н10 – 0,28 МПа находим общее давление в системе:
åNxi=1=å(Nyi /Qi )·P,
Р = 1/S(Nyi/Qi ) = 1/(0,6/0,92 + 0,3/0,37 + 0,1/0,28) =
= 1/(0,65 + 0,81 + 0,36) = 1/1,82 = 0,55 (МПа).
Концентрации компонентов равновесной жидкой фазы рассчитываем:
NxС3Н8 = NyС3Н8 ·Р/QС3Н8 = 0,6·0,55/0,92 = 0,358;
Nxi-С4Н10 = Nyi-С4Н10 ·Р/Qi-С4Н10 = 0,3·0,55/0,37 = 0,446;
Nxn-С4Н10 = Nyi-C4H10 ·Р/Qn-C4H10 = 0,1·0,55/0,28 = 0,196;
SNxi = 0,358 + 0,456 + 0,196 = 1.
Уравнения
Р = 1/S(Nyi /Qi), Р = 1/S( Nyi /Рi нас пара) (4.6)
называются уравнениями конца однократного испарения или уравнениями начала однократной конденсации. Они характеризуют величину упругости паров (давления насыщенных паров) углеводородной смеси, при которой смесь кипит при данной температуре.
Уравнения равновесия (4.4), начала однократного испарения (4.5), начала конденсации (4.6) описывают поведение простых углеводородных смесей при низких давлениях и температурах.
Для практических промысловых расчётов использовать их затруднительно, так как они не учитывают влияние давления и состава смеси на величину давления паров углеводородов, находящихся в смеси. Поэтому для практических расчётов используют не упругости паров углеводородов (давления паров), взятые в чистом виде, а константы равновесия, характеризующие отношение:
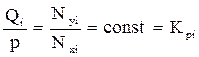 , (4.7)
, (4.7)
где Kpi – константа равновесия i-го компонента при температуре и давлении смеси.
Оценить состав газовой (Nyi) и жидкой (Nxi) фаз можно на основе уравнения материального баланса, записанного для одного моля нефтегазовой смеси (Nzi):
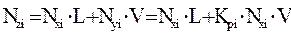 , (4.8)
, (4.8)
где L – мольная доля жидкой фазы;
V – мольная доля паровой фазы;
Nzi – мольные доли компонентов в газонефтяной (пластовой нефти) смеси.
Так как ∑(Nzi) = 1, то сумма мольной доли жидкой фазы (L) и мольной доли паровой фазы (V) равна: V + L = 1. Отсюда следует
V=1 – L. (4.9)
Используя уравнения (4.8 и 4.9), получаем выражение для оценки мольной доли компонента жидкой фазы:
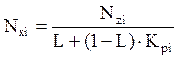 (4.10)
(4.10)
или
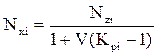 (4.11)
(4.11)
и для оценки мольной доли компонента газовой фазы
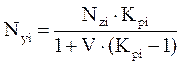 . (4.12)
. (4.12)
Величины V и L оцениваются и уточняются методом последовательных проб и приближений (итераций), исходя из следующих условий
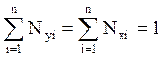 , (4.13)
, (4.13)
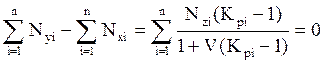 . (4.14)
. (4.14)
Рассмотрим пример. Дан состав газонефтяной смеси (Nzi, доли). Рассчитать равновесные составы газовой (Nyi) и жидкой (Nxi) фаз для давления (Р) = 245 кПа и температуры (Т) = 4,4 °С. Доли жидкой составляющей L = 0,521, газовой составляющей V = 0,479.
Дано: Nzi, доли Кpi
C1 0,3396 61
С2 0,0646 9
С3 0,0987 2,2
SС4 0,0434 0,61
SС5 0,0320 0,157
SС6 0,0300 0,035
SС7 0,3917 0,0032
P = 245 кПа; Т = 4,4 °C; L = 0,521; V= 0,479.
Найти Nxi, Nyi.
Решение. Kрi = f (P, T), для условий задачи находим табличные значения констант фазовых равновесий и рассчитываем состав газовой и жидкой фаз.
Nxi = Nzi/(L + V·Kpi);
Nyi = Nzi/(L/Kpi + V);
Nx1 = 0,3396/(0,521 + 0,479·61) = 0,01;
Ny1 = 0,3396/(0,521/61 + 0,479) = 0,69;
Nx2 = 0,0646/(0,521 + 0,479·9) = 0,01;
Ny2 = 0,0646/(0,521/9 + 0,479) = 0,12;
Nx3 = 0,0987/(0,521 + 0,479·2,2) = 0,06;
Ny3 = 0,0987/(0,521/2,2 + 0,479) = 0,13;
Nx4 = 0,0434/(0,521 + 0,479·0,61) = 0,05;
Ny4 = 0,0434/(0,521/0,61 + 0,479) = 0,03;
Nx5 = 0,032/(0,521 + 0,479·0,157) = 0,05;
Ny5 = 0,032/(0,521/0,157 + 0,479) = 0,01;
Nx6 = 0,03/(0,521 + 0,479·0,035) = 0,05;
Ny6 = 0,03/(0,521/0,035 + 0,479) = 0,002;
Nx7 = 0,3917/(0,521 + 0,479·0,0032) = 0,75;
Ny7 = 0,3917/(0,521/0,0032 + 0,479) = 0,002;
SNxi = 0,98; SNyi = 0,984.
При выполнении инженерных расчётов константы равновесия (Kрi)для различных компонентов находят по таблицам и графикам при известных давлениях и температурах (рис. 4.14). Мольные доли различных компонентов легко определяются, если известны общее количество растворенного в нефти газа (газовый фактор), химический состав газа и относительная молекулярная масса сепарированной нефти.
Уравнение (4.8) при наличии достоверных данных о константах фазовых равновесий углеводородов при различных условиях существования смесей имеет широкое прикладное значение в практике разработки месторождений, нефтедобычи, подготовки скважинной продукции и в нефтепереработке.
Из анализа зависимостей (рис. 4.14) видно, что каждый компонент имеет два значения давления, при которых константы равновесия равны единице: при давлении насыщенных паров компонентов и в точке их схождения справа. Эта точка называется давлением схождения. Если диаграмма составлена при критической температуре смеси, то давление схождения будет критическим. При других температурах схождение будет лишь кажущимся. По данным Д. Катца кажущееся давление схождения, при котором константы равновесия всех компонентов многих нефтей становятся одинаковыми и равными единице, составляет 35–34,5 МПа.
При низких давлениях и температурах константы равновесия углеводородов мало зависят от состава смеси. При высоких давлениях они могут быть найдены экстраполяцией их действительных значений, если известно давление схождения, величина которого в значительной степени определяется составом смеси.
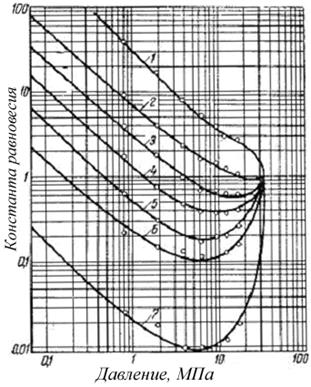
Рис. 4.14. Константы равновесия углеводородов для нефтей с низкой
усадкой при температуре 93,3 оС: 1 – метан; 2 – этан;
3 – пропан; 4 – бутан; 5 – пентан; 6 – гексан;
7 – гептан и высшие углеводороды
В связи с очень большим разнообразием условий залегания нефтей и их состава каждая нефтегазовая смесь характеризуется своими зависимостями констант равновесия от давления и температуры, отличающимися в той или иной степени от приведённых в справочниках. Для корреляции констант равновесия, взятых для сходных смесей из справочников, с результатами лабораторных анализов нефтей и для определения констант равновесия, необходимых для проектирования и анализа разработки конкретных нефтяных месторождений, предложены специальные методы их уточнения, опубликованные в литературе.
Дата добавления: 2019-02-08; просмотров: 1012;











