Адгезия тромбоцитов
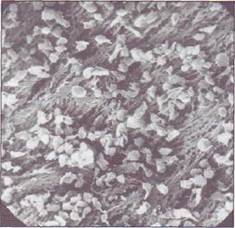
На рис. 22 показаны адгезированные тромбоциты на участке деэндотелизации. Через несколько минут после повреждения сосудистой стенки формируется сплошной слой адгезиро-ванных и агрегированных тромбоцитов, которые являются основой тромбоцитарного тромба (рис. 23).
В процессе адгезии важную роль играют 2 механизма. Один из них - непосредственная адгезия тромбоцитов через рецепторы GPIa-IIa и GPVI к коллагену субэндотелия. Однако это взаимодействие недостаточно для удержания тромбоцитов в местах воздействия высоких скоростей кровотока - артериях и артериолах. Другой ме-
|

|
Рис. 22. Адгезированные тромбоцитына поврежденной (деэндотелизированной) сосудистой стенке
Рис. 23. Тромбоцитарный тромб,сформированный на поврежденной сосудистой стенке
Тромбоциты
ханизм, эффективно удерживающий тромбоциты привысокой скорости кровотока, включает адгезию тромбоцитов, опосредованную молекула-ми адгезии - фактором Виллебранда, фибронек-тином,витронектином, ламинином, тромбоспон-дином и др. In vivo оба эти механизма работают параллельно.Возможно, что первичный контакт тромбоцитов с субэндотелием осуществляется благодаря первому механизму, тогда как окончательная фиксация тромбоцитов происходит за счет формирования связей субэндотелий - фак-тор Виллебранда - GPIb-V-IX и связей, опосредованных другими молекулами адгезии.
Молекулы адгезии
Фактор Виллебранда (vWF) - один из самых больших гликопротеидов плазмы, имеет молекулярную массу от 540 до нескольких тысяч кДа, содержит в цепочке более 2000 аминокислот.
Ген фактора Виллебранда находится на коротком плече 12-й хромосомы. Синтез фактора Виллебранда происходит в эндотелиоцитах и мегака-риоцитах. Фактор Виллебранда из эндотелиоци-гов секретируется или в плазму, или в субэндоте-лиальное пространство; кроме того, он может содержаться в тельцах Вейбла-Палада эндотелиоци-тов (пулы хранения) и секретироваться после стимуляции эндотелиальных клеток. Фактор Виллебранда, синтезированный мегакариоцитами, содержится в альфа-гранулах тромбоцитов.
Информация о синтезе фактора Виллебранда получена в основном при изучении его в культурах эндотелиальных клеток. Первичный продукт синтеза, обозначаемый как пpe-пpo-vWF, найден в эндотелии и тромбоцитах, он иммуно-логически отличается от зрелого фактора Виллебранда. Его уровень снижен у пациентов с болезнью Виллебранда.
Пре-про-vWF содержит 2813 аминокислотных остатков. В эндоплазматическом ретикулу-ме после гликозилирования npe-npo-vWF преобразуется в пpo-vWF, который превращается в зрелый vWF после отщепления пептида, состоящего из 741 аминокислотного остатка. Этот полипептид идентифицируется как антиген II vWF (vWF:AgII).
Процесс димеризации и полимеризации vWF происходит одновременно. Зрелая субъединица
vWF содержит 2050 аминокислотных остатков, 169 из которых - цистеин, сгруппированный в областях, расположенных в амино- и карбокси-концах молекулы (N- и С-концы). Процесс димеризации связан с образованием дисульфидных мостиков между С-концами молекулы, а дальнейшая полимеризация происходит за счет образования дисульфидных связей между N-концами. Конечный продукт накапливается в тельцах Вейбла-Палада в эндотелиоцитах и в α-гранулах тромбоцитов.
Фактор Виллебранда состоит из ряда полимеров прогрессивно увеличивающейся молекулярной массы: разделяют легкие, средние, тяжелые и сверхтяжелые мультимеры. Молекулярная масса vWF варьирует от 540 кДа у димеров до 20 тысяч кДа у самых крупных мультимеров, содержащих от 50 до 100 субъединиц. Самым большим тромбоген-ным потенциалом обладают молекулы vWF с наибольшей молекулярной массой.
В плазме нет мономеров фактора Виллебранда, он всегда образует комплексы. Концентрация vWF в плазме составляет примерно 10 мкг/мл.
При исследовании vWF, содержащегося в пулах хранения, было выявлено, что его молекулярная масса, а следовательно, и тромбогенный потенциал существенно выше, чем у vWF, содержащегося в плазме, и наиболее высок в а-гранулах тромбоцитов (так называемый сверхвысокомолекулярный фактор Виллебранда). После сильной стимуляции тромбоцитов и эндотелиоцитов сверхвысокомолекулярный фактор Виллебранда некоторое время обнаруживается в плазме. Однако потом в сосудистом русле молекулярная масса vWF довольно быстро снижается до «нормальной» под воздействием кальпаиновых про-теаз плазмы. Такое распределение позволяет создавать высокий тромбогенный потенциал в местах повреждения эндотелия при выбросе vWF из пулов хранения, в то же время сохраняя тромбогенный потенциал на «обычном» уровне в интак-тном сосудистом русле.
Фактор Виллебранда имеет два пути секреции: непосредственная секреция после синтеза и полимеризации, которая создает определенный уровень vWF в крови, и регуляторная секреция из пулов хранения в ответ на различную стимуляцию. Фоновая активность vWF в крови у каждого человека может меняться в значительных
Тромбоциты
пределах. Реализация vWF из тромбоцитарных гранул возникает при активации тромбоцитов под воздействием различных физиологических и нефизиологических индукторов (АДФ, коллаген, адреналин, вазопрессин, серотонин, тромбин, простагландин Е1, тромбоксан А2 и др.), и в том числе плазменного vWF. Уровень vWF в крови возрастает при воспалении различного генеза, повреждении эндотелия сосудов при васкулитах, стрессе, у женщин во время беременности. Повышение активности vWF в патологических ситуациях может способствовать развитию тромбозов.
Вторичные изменения структуры vWF и его активности являются следствием иммунных процессов, тромботической тромбоцитопенической пурпуры, гемолитико-уремического синдрома и др. Описаны заболевания (болезнь Виллебран-да, тип Виченза; врожденная тромботическая тромбоцитопеническая пурпура), при которых дефект этих ферментов приводит к накоплению сверхвысокомолекулярных мультимеров vWF и преждевременной секвестрации тромбоцитов из кровотока.
Основными функциями фактора Виллебранда являются:
• опосредование адгезии тромбоцитов к субэн-
дотелиальным структурам, в первую очередь
к коллагену, и последующей агрегации тром
боцитов (участие в первичном сосудисто-
тромбоцитарном гемостазе);
• связывание свободного фактора VIII и защи
та его молекулы от преждевременной инак
тивации (участие во вторичном плазменном
гемостазе).
Опосредование адгезии и агрегации тромбоцитов.Роль фактора Виллебранда в адгезии и агрегации тромбоцитов наиболее велика в условиях воздействия высоких скоростей кровотока. Молекулы vWF специфически связываются с рецепторами тромбоцитов GPIb-V-IX и коллагеном субэндотелия. Это обеспечивает прочную фиксацию тромбоцитов к субэндотелиальным структурам в тех участках сосудистого русла, где сила потока крови существенно мешает формированию гемостатической пробки и другие механизмы адгезии не могут обеспечить надежной фиксации тромбоцитов. В частности, известно, что vWF является ключевым при формировании
тромба в мелких артериях, артериолах и артериальных капиллярах. В местах, где интенсивность кровотока невелика, роль vWF уменьшается, преобладающим становится взаимодействие, опосредованное другими молекулами, в том числе прямая адгезия тромбоцитов к коллагену посредством GPIa-IIa.
Агрегация тромбоцитов в условиях воздействия активного тока крови тоже происходит с участием фактора Виллебранда. Помимо GPIb-V-IX, с фактором Виллебранда также связывается GPIIb-IIIа. Возможно, что это взаимодействие является ключевым в процессе агрегации в местах сосудистого русла с высокой скоростью тока крови.
Тест агрегации, опосредованный фактором Виллебранда, в лабораторных условиях может быть выполнен с использованием фиксированных тромбоцитов. Видимо, эта реакция не требует энергетических затрат. Однако стимуляция рецептора Ib-V-IX приводит к активации тромбоцита.
Учитывая особенности фактора Виллебранда, можно сказать, что он выполняет функцию «биологического клея», фиксируя тромбоциты на поврежденной сосудистой стенке (рис. 24).
Другая функция фактора Виллебранда - защита ф.VIII от протеолитической деградации системой протеин С - протеин S. Вплазме vWF является белком-носителем фактора VIII.
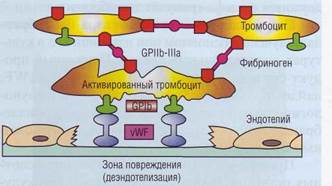
Рис. 24. Фактор Виллебранда (vWF)выполняет роль «биологического клея», прикрепляя к коллагену субэндотелия адгезированные тромбоциты через гликопротеиновый комплекс GPIb-V-IX, Тромб увеличивается в размерах по мере адгезии и агрегации новых тромбоцитов, скрепление которых в агрегат обеспечивает фибриноген, имеющий дива-лентную структуру и взаимодействующий с рецепторами GPIIb-llla
Тромбоциты
Молярная концентрация vWF примерно в 50 раз выше, чем молярная концентрация фактора VIII. Фактор VIII практически весь связан с vWF (рис. 25). Это предупреждает быструю деградацию ф.VШ под влиянием протеина С. Связанный с vWF фактор VIII защищен от протео-литической инактивации в плазме, поскольку у него заблокированы сайты связывания с фос-фолипидной матрицей и заблокированы сайты связывания с протеином С. Поэтому недостаток vWF часто вызывает вторичный дефицит ф.VIII.
В области повреждения сосуда, в процессе vWF-опосредованной адгезии тромбоцитов происходит контакт комплекса vWF-ф.VIII и тромбина (ф.Па), который активирует ф.III, освобождая его из комплекса с фактором Виллебранда.
Фибронектин(плазматический, субэндоте-лиальный и тромбоцитарный) - гранулярный контактный белок, который способен образовывать комплексы с GPIc-Па-рецепторами тромбоцитов и коллагеном. Сродство фибронектина к коллагену и тромбоцитам меньше, чем у фактора Виллебранда, однако молекулярная концентрация его выше. Видимо, фибронектин является основной молекулой адгезии в венозной и капиллярной сети, образуя ось: тромбоцитарный рецептор GPIc-IIa - фибронектин - коллаген. Гликопротеиновый комплекс GPIc-IIa распознает в фибронектине RGD последовательность и осуществляет рецепторную функцию как в интактных, так и в активированных тромбоцитах. Характерная аминокислотная последовательность RGD - трипептид Arg-Gly-Asp имеется во всех адгезивных белках крови, белках а-гранул тромбоцитов, фибриногене, факторе Виллебранда, фибронектине, витронектине и других белках. Наличие RGD-последовательно-сти на фибронектине определяет зависимость процесса его взаимодействия со своим рецептором на тромбоцитах от двухвалентных катионов Са2+ и Mg2+.
Витронектин- гликопротеин плазмы, субэндотелия и а-гранул тромбоцитов. Имеет значение в гемостатических реакциях и в восстановлении поврежденных тканей сосудистой стенки. Витронектин, как и другие адгезивные белки, содержит трипептид RGD, распознающийся интегриновыми рецепторами эндотели-альных клеток и тромбоцитов. Витронектино-
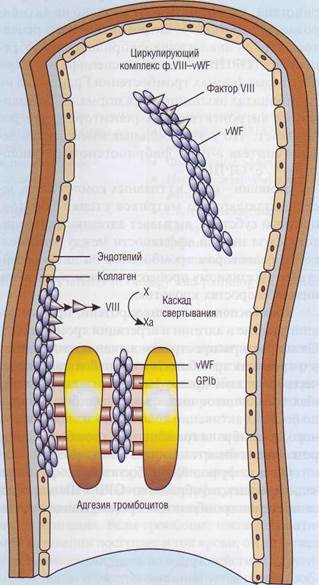
Рис. 25. Комплекс фактор VIII - фактор Виллебранда (ф.Vlll—vWF)состоит из 2 отдельных белков, которые выполняют в гемостазе разные функции, имеют разную химическую и иммунологическую структуру. Фактор VIII необходим для активации фактора X в каскаде свертывания крови, его дефицит вызывает гемофилию А. Фактор Виллебранда (vWF) - полимерный белок, который составляет основную массу комплекса. Он необходим для адгезии тромбоцитов к поврежденной стенке сосудов, обеспечивая взаимодействие коллагена с гликопротеиновым комплексом тромбоцитов GPIb-V-IX. Кроме того, он участвует в агрегации тромбоцитов, взаимодействуя с интегринами GPIIb-llla. Недостаток vWF приводит к болезни Виллебранда
Тромбоциты
вый рецептор на тромбоцитах функционирует постоянно, что отличает его от рецептора фибриногена, который работает только на активированных клетках. У витронектинового рецептора р-цепь аналогична фибриногеновому рецептору (GPIIIa), но а-цепь специфична. При некоторых формах тромбостении Гланцмана на тромбоцитах экспонируется нормальное количество витронектиновых рецепторов, что доказывает, что у этих больных имеет место дефект синтеза а-цепи фибриногенового рецептора, т. е. GPIIb.
Ламинин- один из главных компонентов эк-страцеллюлярного матрикса стенки сосудов, плотный субстрат, вызывает адгезию тромбоцитов. Из-за низкой аффинности между этим белком и рецептором тромбоцитов он лишь содействует адгезивному процессу, причем только при низких скоростях кровотока.
Тромбоспондин- гликопротеин, принимающий участие в адгезии и агрегации тромбоцитов. Он широко распространен в тканях, содержится в α-гранулах тромбоцитов и в небольшом количестве в плазме крови. На поверхности интакт-ных тромбоцитов очень мало тромбоспондина, но после их активации количество экспонированного на мембране тромбоцитов тромбоспондина резко увеличивается.
Одна из функций тромбоспондина - стабилизация комплекса фибриноген-GPIIb-IIIa в процессе агрегации тромбоцитов. Тромбоспондин увели-
чивает его прочность и переводит агрегацию тромбоцитов из обратимой в необратимую (рис. 26).
Помимо этого, тромбоспондин связывается с рядом коагуляционных факторов (тромбином, факторами IХа, Ха), что приводит к повышению их локальной концентрации и защищает от действия ингибиторов.
Дата добавления: 2016-08-06; просмотров: 3730;











