Методы, основанные на измерении электропроводности тканей
В основе импедонсометрического определения кровотока лежит различие в электропроводности: у плотных тканей этот показатель в 5-10 раз ниже, чему биологических жидкостей [127, 168]. Следовательно, изменения сопротивления тканей, обусловленные пульсирующим кровотоком, могут быть зарегистрированы и использованы для расчета его объема. Первые попытки применения электрических измерений для изучения функций кровообращения были предприняты Н. Cremer (1907), D. Rapaport и D. Ray (1927), E. Atzler и G. Lehmann (19321 и Н. Mann (1 937) (цит. по [122, 127, 150]). Однако классическими, основополагающими стали работы А.А. Кедрова (1941, 1948, 1949 и др.) [96, 97], W. Holtzer, К. Polzer и A. Mario (1946 [764]: этим авторам принадлежит термин "реография"), J. Nyboer (1959, 1960, 1962, 1970 и др.) [1127]
Полное электрическое сопротивление ткани (импеданс) состоит из двух компонентов. Первый из них — так называемое омическое или активное сопротивление, обусловленное наличием заряженных молекул и количественно характеризующееся величиной электропроводности. Второй компонент импеданса называется емкостным (реактивным, поляризационным) сопротивлением и возникает из-за явлений поляризации на границах различных тканевых структур, являющихся диэлектриками [1127]. Элементами емкостного сопротивления становятся, в частности клеточные мембраны и граница электрод-кожа. В 1941 г. Алексей Алексеевич Кедров (род.1906 г.) — впоследствии заведующий кафедрой госпитальной терапии Ленинградского педиатрического медицинского института (1970-1982 гг.) — впервые показал, что колебания кровенаполнения тканей приводят к изменениям преимущественно активного сопротивления, а не емкости тканей [96]. Величина импеданса выражается следующей формулой [150]:
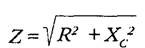 (4)
(4)
В этой формуле Z — импеданс, R — омическое сопротивление, Хc. — емкостное сопротивление В свою очередь, емкостное сопротивление зависит от частоты пропускаемого через ткань тока:
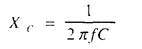 (5)
(5)
Здесь f — частота тока, Гц, С — величина емкости, Ф. Подставив выражение (5) в исходную формулу (4), получим:
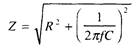 (6)
(6)
Таким образом, соотношение между омическим и емкостным компонентами зависит от частоты тока: чем она выше, тем меньше емкостной компонент. При достаточно высокой частоте (более 1 кГц — Н.Р. Schwan,1955 — цит. по [122]) его величиной можно пренебречь без ущерба для точности измерения омической составляющей импеданса. Кроме того, повышение частоты тока, как и снижение его силы, диктуются опасностью специфического действия на возбудимые ткани [96, 122].
Омическое сопротивление тканей, в свою очередь, состоит из двух составляющих. Первая. постоянная, определяется фоновым кровенаполнением ткани, тогда как вторая, переменная, отражает его колебания во время сердечного цикла: приток крови снижает сопротивление. отток его увеличивает. Переменная составляющая сравнительно невелика — по данным разных авторов, от 0,05 до1% общего импеданса ткани (F. Jenker, 1959; К. Polzer и F. Schuhfried, 1962 — цит по [150]). Выделение, усиление, регистрация и анализ переменной компоненты электрического импеданса тканей и составляют сущность метода реографии. При этом все известные формулы расчета построены на предположении о том, что в течение систолы сконцентрированный в одной точке ударный объем крови равномерно заполняет участок тела между электродами, форма которого приближенно описывается той или иной стереометрической фигурой [1127]. Отсюда вытекают два главных источника методических ошибок реографии: неравномерная в реальных условиях динамика кровенаполнения тканей и отличие истинной формы тела от расчетного приближения [174].
Основная методическая проблема реографии с точки зрения биофизики состоит в высокой степени неопределенности реальных путей прохождения тока через тело человека, независимо от "правильности" своей формы состоящее из элементов с самыми разными электрическими и геометрическими характеристиками [135, 150, 174]. Поскольку источником пульсирующего потока является сердце, для измерения МОК логично регистрировать реограмму грудной клетки. Удобство этой ток называемой торакальной реографии [56, 161, 895 и др.] еще и в том, что форма грудной клетки наиболее близка к цилиндрической, а такое приближение значительно облегчает расчеты. За рубежом до настоящего времени основная доля импедансометрических измерений выполняется по торакальной методике [291, 309, 505, 750, 791, 1099, 1419,1430, 1610 и мн. др.]. Однако дыхание — циклические изменения внутригрудных объемов электрического изолятора [воздуха) — вызывает существенно большие колебания импеданса, чем работа сердца. Грубые колебания изоэлектрической линии резко затрудняют анализ кривой [174]. Кроме того, расположенные на шее и на уровне мечевидного отростка кольцевые электроды оказываются в проекции операционного поля при самом широком спектре хирургических вмешательств — от операций на щитовидной железе до работы в верхнем этаже брюшной полости. Все это делает торакальную реографию не слишком удобной для интраоперационного мониторинга. Одна из наиболее удачных попыток решения этих проблем была предпринята в Ленинграде в начале 70-х годов сотрудником Военно-медицинской академии Михаилом Ивановичем Тищенко (1929-1984). Отличительными особенностями его метода, названного в оригинале тетраполярной интегральной реографией тела человека (ИР ГТ, 1973 [179,180]), являются:
1) Тетраполярная регистрация сигнала с использованием четырех токовых и четырех потенциальных электродов, размещенных попарно на руках и ногах;
2) Расчетная процедура, корректирующая отличие формы проводника — участка тела между электродами — от цилиндрической;
3) Превращение дыхательных колебаний изолинии, сильно сглаженных отдаленным расположением электродов, из шума в подвергаемый анализу полезный сигнал;
4) Предположение о том, что кровь притекает в течение систолы с постоянной скоростью, а венозный отток равномерен на протяжении всего кардиоцикла.
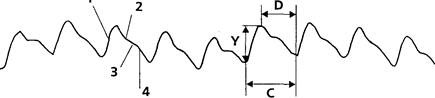
На кривой ИРГТ (рис. 4), как и на сфигмограмме, выделяют: главную волну (анакроту), отражающую систолу ЛЖ (1), инцизуру (2) идикротический подъем (3), связанные с отраженной волной от закрывшихся клапанов аорты и катакроту (4), соответствующую диастоле. Кроме того, выделяются обусловленные дыханием колебания изолинии, частота которых в 4-5 роз ниже ЧСС. Анализ кривой требует, во-первых, распознавания отдельных кардиоциклов с определением их границ и, во-вторых, разметки каждого цикла для измерения его характеристик. После разметки кривой оказывается возможным измерить три параметра кардиоцикла, необходимых для расчета величины ударного объема крови по формуле М.И. Тищенко. Это амплитуда кардиоцикла (Y) — разность ординат точек начала и конца систолы, длительность кардиоцикла (С) — разность абсцисс точек начала последовательных систол и длительность катакроты |D) — разность абсцисс точек начала следующей и конца предыдущей систолы. Расчет величины УОК выполняется по следующей формуле:
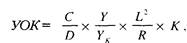
где Y — амплитуда калибровочного сигнала реографа; L — рост исследуемого, см: R — базисное сопротивление между электродами (постоянная составляющая омического сопротивления), Ом. К — корректирующий коэффициент, учитывающий отличие формы токопроводящей среды от цилиндрической, зависимость между ростом и межэлектродным расстоянием и электропроводность крови (в среднем, r= 150 О/м•см: в случае, если гематокрит значимо отличается от нормы, необходимо вводить поправку!). Величина К для женщин составляет 0,246, для мужчин — 0,275 [180]. Расчетная формула М.И. Тищенко (7) носит, таким образом, эмпирический характер, причем источником ошибок являются отличия пропорций тела и электропроводности крови от предполагаемых авторов величин. Однако, несмотря на выдвинутые теоретические возражения [207 и др.], ИРГТ по М.И. Тищенко продемонстрировала хорошее совпадение результатов с референтными методами [4, 21, 46, 80, 884].
Именно данная методика легла в основу отечественного варианта реомониторинга — компьютерного анализа реосигнала в реальном времени, позволяющего оценивать динамику режима кровообращения.
Дальнейшее развитие импедансометрии идет в направлениях совершенствования расчетных формул [308, 470, 1128, 1429], создания "усредняющих" алгоритмов обработки кривой, снижающих влияние артефактов [487, 551], внедрения импедансного мониторинга ОПСС [1474], оптимизации формы электродов [668] и способов их размещения (например, в пищеводе [262]), выработки критериев нормы, в частности в педиатрии [791, 1044] и неонатологии [1359], выявления реографических симптомов отдельных состояний и заболеваний [1556]. Сегодня импедансометрическое измерение МОК наиболее широко используется в операционной в тех случаях, когда термодилюционный метод неуместен с точки зрения объема операции [758, 839, 926, 1028, 1318, 1347, 1357, 1474]. Именно те нередкие ситуации, когда риск катетеризации ЛА может превысить риск малоинвазивного вмешательства, со всей очевидностью оправдывают призывы к рутинному использованию импедансометрического мониторинга МОК во время анестезии [1028, 1191].
Дата добавления: 2020-11-18; просмотров: 730;











