Опыт 6.5.3. Реакция с диметилглиоксимом (реактивом Чугаева)
Катионы Ni2+ при реакции с диметилглиоксимом (реактивом Чугаева) при рН 6-9 образуют малорастворимое в воде внутрикомплексное соединение розово-красного цвета - бис-диметилглиоксиматоникель (II) (старое название - «никельдиметилглиоксим»):
2C4H8N2O2 + NiSO4 + 2NH4OH → Ni(C4H7N2O2)2↓ + (NH4)2SO4 + 2H2O
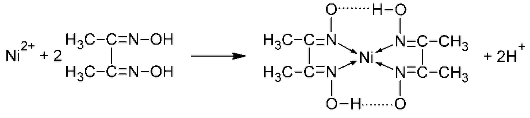
(здесь точками обозначены водородные связи OH). Обычно реакцию проводят в среде аммиака.
Осадок растворяется в сильных кислотах и щелочах, нерастворим в растворах аммиака.
Катионы кобальта (II) в малых концентрациях не мешают определению никеля. Мешают катионы Cu2+, Pb2+, Fe2+, Fe3+. Разработаны методики для устранения их мешающего действия.
Эта реакция, впервые предложенная Л.А.Чугаевым, является наиболее характерной для катионов никеля (II) и высокочувствительной: предел обнаружения равен 0,16 мкг, предельное разбавление - 3 105 мл/г. Чувствительность реакции повышается в присутствии небольших количеств окислителей (бром, йод и др.), переводящих никель (II) в никель (III), комплекс которого с диметилглиоксимом имеет еще более интенсивную окраску.
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли концентрированного раствора аммиака и каплю спиртового раствора диметилглиоксима. Выпадает розово-красный осадок комплекса диметилглиоксимата никеля.
Реакцию можно проводить капельным методом на фильтровальной бумаге. Для этого на листок фильтровальной бумаги наносят каплю раствора соли никеля (II), затем - каплю спиртового раствора диме-тилглиоксима. Бумагу держат над склянкой с концентрированным раствором аммиака (в парах аммиака) до появления розово-красного пятна.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 6.5.4. Реакция ссульфид-ионами
Катионы Ni2+ с сульфид-ионами S2- в нейтральной среде образуют черный осадок сульфида никеля (II) NiS.
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли раствора сульфида натрия. Выпадает черный осадок.
Записать наблюдение и уравнение реакции в тетрадь.
Опыт 6.5.5. Реакция сщелочью и бромной (хлорной) водой
Со смесью щелочи и бромной (хлорной) воды соль двухвалентного никеля дает черно-бурый осадок гидроксида никеля (III) Ni(OH)3:
2Ni(OH)2 + 2NaOH + Br2 = 2Ni(OH)3 + 2NaBr
Выполнение опыта:
В пробирку поместить 3-4 капли раствора соли никеля (II), прибавить 3-4 капли раствора гидрооксида натрия и бромную или хлорную воду. Выпадает черно-бурый осадок.
Записать наблюдение и уравнение реакции в тетрадь. Рассмотреть уравнение с помощью метода электронного баланса.
Контрольные вопросы
1. Назовите групповые реагенты на катионы шестой аналитической группы.
2. Перечислите катионы, входящие в состав этой группы.
3. Какие элементы, катионы которых входят в состав шестой группы, проявляют переменную степень окисления?
4. Какие катионы шестой группы подвергаются гидролизу?
5. Напишите общую формулу комплексных соединений катионов шестой группы с аммиаком. Дайте названия этим соединениям.
6. Перечислите органические реагенты, применяемые для обнаружения катионов шестой группы.
7. Как действуют растворы щелочей и аммиака на катионы пятой и шестой аналитических групп? Напишите соответствующие уравнения реакций.
8. Как действует пероксид водорода в щелочной среде на кобальт (II)? Напишите соответствующее уравнение реакции и укажите цвет продукта реакции.
9. Какую окраску имеют аммиачные комплексы катионов шестой группы? Напишите их формулы.
10. Какую окраску имеетсульфид кадмия? Из каких растворов его выделяют?
11. Летучие соли каких ионов шестой групп окрашивают пламя газовой горелки? Укажите цвет пламени.
12. Для чего при растворении основной соли кобальта (II) CoOHCl и HgNH2Cl в избытке концентрированного раствора аммиака добавляют сухую соль аммония? Дайте обоснование, используя уравнения реакций растворения этих солей.
13. Какую реакцию можно использовать для дробного обнаружения ртути (II) в смеси катионов пятой и шестой групп? Напишите ее уравнение в ионном виде.
14. Почему реакцию образования диметилглиоксимата никеля проводят в аммиачной среде? Поясните, написав соответствующее уравнение реакции.
15. Напишите формулы комплексных соединений:
16. а) Cu2+ скупроном,
17. б) Co2+ с 1-нитрозо-2-нафтолом.
18. При выполнении какой аналитической реакции катиона кобальта (II) применяют экстракцию? Объясните необходимость ее применения.
Глава 7
Дата добавления: 2020-11-18; просмотров: 4191;











