Сила тока в замкнутой цепи прямо пропорциональна ЭДС источника тока и обратно пропорциональна полному сопротивлению всей цепи
I= ε
R+ r
ε -электродвижущая сила источника тока
R – сопротивление всего внешнего участка цепи
r– внутреннее сопротивление источника тока
Электрический ток производит тепловое, химическое, магнитное и др. действия. При прохождении тока I по участку цепи сопротивлением R, проводник нагревается.
Выделяющееся в проводнике количество теплоты Q прямо пропорционально квадрату силы тока, сопротивлению и времени:(закон Джоуля-Ленца):
Q =I2 Rt , где t – время пропускания тока.
Вещества, раствор которых в воде и некоторых других диэлектрических жидкостях проводит электрический ток, называют электролитами. К ним относятся соли, кислоты и щелочи. Молекулы электролита и растворителя являются дипольными. Каждую молекулу электролита окружают молекулы растворителя и силами кулоновского притяжения разрывают на два противоположно заряженных иона. Это явление называют электролитической диссоциацией. Некоторые ионы в процессе теплового движения воссоединяются в нейтральные молекулы. Процесс, обратный диссоциации, называют рекомбинацией.
Степенью или коэффициентом диссоциацииaназывают отношение числа диссоциированных молекул электролитаnк общему числу его молекул n0 в единице объема.

Степень диссоциации зависит от природы электролита и растворителя, концентрации электролита 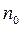 и температуры. При повышении температуры степень диссоциации увеличивается, т.к. увеличивается тепловое движение молекул и увеличивается число распадов.
и температуры. При повышении температуры степень диссоциации увеличивается, т.к. увеличивается тепловое движение молекул и увеличивается число распадов.
Если в электролит опустить два электрода, подключенных к полюсам источника тока, то положительные ионы будут двигаться к катоду, отрицательные к аноду. Это встречное движение разноименных ионов (катионов и анионов) и есть электрический ток в жидкости, а проводимость жидкости является ионной.
Плотность электрического тока в жидкостях, как и в металлах
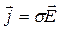
Здесь s- удельная проводимость s = a q n0 ( u+ + u-), где a - степень диссоциации, q – заряд иона, n0- концентрация ионов в растворе электролита, u+ , u- - подвижности положительных и отрицательных ионов в растворе.
Подвижности анионов и катионов неодинаковы. Они зависят от химической структуры и от вязкости раствора электролита. При повышении температуры подвижности ионов возрастают за счет уменьшения вязкости жидкости.
По физическому смыслу подвижность иона равна скорости равномерного движения этого иона при напряженности электрического поля Е=1В/м.
Удельная проводимостьsесть величина, обратная удельному сопротивлению r, т.е. 
Прохождение электрического тока через электролит сопровождается выделением вещества на электродах. Этот процесс можно наблюдать также при пропускании тока через газ. Положительно заряженный ион (катион), подходя к катоду, снимает с него недостающее количество электронов и превращается в нейтральный атом, оседая на катоде. Отрицательно заряженный ион (анион), подходя к аноду, отдает ему лишние электроны и тоже оседает на аноде в виде нейтрального атома. Таким образом, на электродах оседает чистое вещество.
Дата добавления: 2020-11-18; просмотров: 528;











