Идентификация катионов неорганических веществ
АНАЛИТИЧЕСКАЯ ХИМИЯ
Закономерности, в соответствии с которыми проводятся исследования качественного и количественного состава веществ, композиционных материалов и других объектов изучаются аналитической химией.
Основанием для проведения исследования является наличие аналитического сигнала, т.е. функциональной зависимости того или иного измеряемого свойства вещества от его содержания в анализируемом объекте. В качественном анализе только фиксируется наличие аналитического сигнала, в количественном ─ измеряется его интенсивность. В любом случае до проведения количественных исследований необходимо иметь сведения о качественном составе анализируемого объекта.
Современные установки для проведения исследований представляют собой достаточно сложные системы и решают задачи проведения эксперимента и интерпретацию его результата, выдавая в готовом виде сведения об анализируемом объекте (рис. 6.1).

Рис. 6.1 − Принципиальная схема химико-аналитической установки
6.1. КАЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ
Классический анализ неорганических веществ проводят так называемым «сухим» или «мокрым» (в растворах) путём. Сухие соли, помещённые на платиновую или нихромовую проволочку, окрашивают бесцветное пламя газовой горелки в специфические цвета. В современных пламенных фотометрах не просто фиксируется цвет, но количественно анализируется спектр веществ, переведенных в атомарное состояние.
Методы качественного анализа чаще всего базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора.
Используемые для обнаружения реакции должны быть по возможности специфическими (селективными) и обладать достаточно высокой чувствительностью.
Идентификация катионов неорганических веществ
Для идентификации с помощью образования труднорастворимых соединений используют как групповые, так и индивидуальные осадители.
Групповой реагент NaCl осаждает ионы Ag+, Pb2+, Hg2+,
групповой реагент (NH4)2CO3осаждает ионы Ca2+, Sr2+, Ba2+,
групповой реагент (NH4)2Sосаждает ионыAl3+, Cr3+, Fe2+, Fe3+, Mn2+, Co2+, Ni2+, Zn2+.
Если присутствуют несколько катионов, то любой катион можно идентифицировать с помощью определенной (специфической) реакции, если удалить другие катионы, мешающие этой идентификации.
Ниже приводятся некоторые качественные реакции.
Обнаружение ионов железа (II) и (III)
Катион железа (III) легко обнаруживается с помощью бесцветного раствора, содержащего тиоцианат-ион NCS‾ (роданид-ион). При действии NCS‾ на раствор соли железа (III) образуется соединение кроваво-красного цвета − тиоцианат железа (III) Fе(NCS)3:
Fe3+ + 3 NCS‾ → Fe(CNS)3.
Гексацианоферрат (II) калия (жёлтая кровяная соль) также является специфическим реактивом на ион железа (III):
3K4[Fe(CN)6] + 4Fe3+ → Fe4[Fe(CN)6]3 + 12К+.
Образуется берлинская лазурь.
Гексацианоферрат (III) калия (красная кровяная соль) является специфическим реактивом на ион железа (II):
2K3[Fe(CN)6] + 3Fe2+ → Fe3[Fe(CN)6]2 + 6К+.
Образуется турнбулева синь.
Обнаружение ионов К+ иNa+
Катионы натрия и калия относятся к I аналитической группе, которая характеризуется отсутствием группового реагента, т. е. реактива, способного осаждать все катионы этой группы из их растворов.
Летучие соединения металлов окрашивают пламя горелки:
К+ в фиолетовый цвет,
Na+ в жёлтый цвет.
Обнаружение ионов ионов S-элeментов II A группы
ИонMg2+
Групповой реагент карбонат аммония (NH4)2СОз с раствором соли магния образует белый аморфный осадок основной соли (MgOH)2CO3, растворимый в избытке NH4Cl:
2MgCl2 + 2(NH4) 2CO3 + Н2О → (MgOH) 2CO3↓+ СО2 + 4NH4Cl,
2Mg2+ + 2CO32- + Н2О → (MgOH)2CO3↓ + CO2.
Едкие щелочи и гидроксид аммония образуют с растворами солей магния белый аморфный осадок Mg(OH)2, хорошо растворимый в кислотах и растворах аммонийных солей:
Mg2+ + 2OН‾ → Mg(OH)2↓.
Растворение в кислотах:
Mg(OH)2 + 2H+ → Mg2+ + 2Н2O.
Растворение в растворах аммонийных солей:
Mg(OH)2 + 2NH4+ ↔ Mg2+ + 2NH4OH.
Ион Ва2+
Групповой реагент карбонат аммония (NН4)2СО3 осаждает катион Ва2+ из растворов его солей в виде белого аморфного постепенно кристаллизующегося осадка ВаСО3:
BaCl2 + (NH4) 2CO3 → ВаСО3↓ + 2NH4Cl,
Ва2+ + CO32‾ → ВаСО3↓.
Осадок хорошо растворим в кислотах, в том числе и слабых.
Дихромат калия К2Сг2O7 образует с раствором соли бария желтый осадок ВаСгO4, нерастворимый в уксусной кислоте, в отличие от хромата стронция (хромат кальция хорошо растворяется в воде):
2Ba2+ + Сг2O72- + Н2O → 2ВаСгO4↓ + 2H+.
Реакцию проводят при избытке CH3COONa, который реагирует с образующимися ионами Н+, смещая равновесие вправо вследствие образования малодиссоциированной уксусной кислоты:
СН3СОO‾ + Н+ → СН3СООН.
Ион Ba2+ также можно обнаружить с помощью сульфат-иона SO42‾:
Ba2+ + SO42- → BaSO4↓
Образуется творожистый белый осадок.
Ион Са2+
Групповой реагент карбонат аммония (NН4)2СО3 осаждает из растворов солей кальция аморфный белый осадок СаСО3, который при нагревании переходит в кристаллический:
CaCl2 + (NH4) 2CO3 → СаСО3↓ + 2NH4C1,
Ca2+ + CO32‾ → СаСО3↓.
Осадок легко растворяется в минеральных и уксусной кислотах.
Оксалат аммония (NH4)2C2O4 образует с раствором соли кальция белый кристаллический осадок, растворимый в соляной, но не растворимый в уксусной кислоте:
CaCl2 + (NH4)2C2O4 → СаС2O4↓ + 2NH4C1,
Ca2+ + С2O42‾ → СаС2O4↓.
Аналогичный осадок дают ионы Ва2+ и Sr2+. Поэтому этой реакцией можно обнаружить Са2+ только при отсутствии ионов бария и стронция.
Ион Sr2+
Групповой реагент карбонат аммония (NН4)2СО3 осаждает карбонат стронция белого цвета, растворимый в уксусной, соляной и азотной кислотах:
SrCl2 + (NH4)2CO3 → SrCO3↓ + 2NH4C1.
Насыщенный раствор гипса CaSO4 . 2H2O (гипсовая вода) образует с ионами Sr2+ белый осадок сульфата стронция:
Sr2+ + SO42‾ → SrSO4↓.
Однако при действии гипсовой воды ион стронция дает не обильный осадок, а только помутнение, появляющееся не сразу из-за образования пересыщенного раствора. Появление осадка ускоряют нагреванием.
Реакция служит для обнаружения Sr2+ только при отсутствии Ba2+, которой с гипсовой водой вызывает помутнение, появляющееся сразу, так как растворимость BaSO4 меньше растворимости SrSO4 (Ks0(BaSO4) = 1,1 . 10-10, Ks0(SrSO4) = 2,8 . 10-7).
Гипсовая вода не образует осадков с растворами солей кальция ни на холоду, ни при нагревании. Этим ион Ca2+ отличается от ионов Ba2+ и Sr2+.
Ион NH4+
Влажная лакмусовая бумажка в растворе аммиака становится синей, потому что водный раствор аммиака – слабое основание, фенолфталеин подтверждает это - становится малиновым. Стеклянная палочка, смоченная в концентрированной соляной кислоте, при внесении в атмосферу аммиака вызывает появление густого белого дыма, вызванного выделением хлорида аммония
NH3 + HCl → NH4Cl.
Качественные реакции на рассмотренные выше и некоторые другие катионы представлены в табл. 6.1.
Таблица 6.1
Качественные реакции на некоторые катионы
| Катион | Воздействие или реактив | Наблюдаемая реакция |
| Li+ | Пламя | Карминово-красное окрашивание |
| Na+ | Пламя | Жёлтое окрашивание |
| K+ | Пламя | Фиолетовое окрашивание |
| Са2+ | Пламя | Кирпично-красное окрашивание |
| (NН4)2СО3 | CaCl2 + (NH4) 2CO3 → СаСО3↓ + 2NH4C1 осадок белого цвета | |
| (NH4)2C2O4 | CaCl2 + (NH4)2C2O4 → СаС2O4↓ + 2NH4C1 осадок белого цвета | |
| Mg2+ | (NН4)2СО3 | 2MgCl2 + 2(NH4) 2CO3 + Н2О → (MgOH) 2CO3↓+ СО2 + 4NH4Cl белый аморфный осадок, растворимый в избытке NH4Cl |
| NaOH | Mg2+ + 2OН‾ → Mg(OH)2↓ белый аморфный осадок | |
| Sr2+ | Пламя | Карминово-красное окрашивание |
| (NН4)2СО3 | SrCl2 + (NH4)2CO3→ = SrCO3↓ + 2NH4C1 белый осадок, растворимый в уксусной кислоте | |
| CaSO4 . 2H2O | Sr2+ + SO42-→ SrSO4↓ белый осадок | |
| Ва2+ | Пламя | Жёлто-зелёное окрашивание |
| SO42‾ | Ва2+ + S042‾ → BaS04 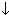 белый творожистый осадок, не растворимый в кислотах
белый творожистый осадок, не растворимый в кислотах
| |
| Cu2+ | Вода | Гидратированные ионы Cu2+ имеют голубую окраску |
| NH4OH | Cu2+ + 4 NH4OH → [Cu(NH3)4]2+ + 4H2O ярко-синее окрашивание | |
| Pb2+ | S2‾ | Pb2+ + S2‾ → PbS↓ осадок чёрного цвета |
| J‾ | Pb2+ + J‾ → PbJ2↓ осадок жёлтого цвета | |
| Ag+ | Аg+ + Cl‾ → AgCl 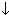 белый осадок нерастворимый в HNO3 , но растворимый в контентрированном растроре аммиака
белый осадок нерастворимый в HNO3 , но растворимый в контентрированном растроре аммиака
|
Продолжение табл. 6.1
| Fe2+ | K3[Fe(CN)6] | 2K3[Fe(CN)6] + 3Fe2+ → Fe3[Fe(CN)6]2 + 6К+ осадок турнбулевой сини |
| Fe3+ | K4[Fe(CN)6] | 3K4[Fe(CN)6] + 4Fe3+ → Fe4[Fe(CN)6]3 + 12К+ осадок берлинской лазури |
| КNCS | Fe3+ + 3 NCS‾ → Fe(CNS)3 кроваво-красное окрашивание | |
| Al3+ | Щёлочь | Выпадение осадка гидроксида алюминия при приливании первых порций щелочи и его растворение при дальнейшем приливании |
| NH4+ | Щёлочь, нагрев | t 0
NH4+ + ОН‾ → NH3  + Н20
запах аммиака + Н20
запах аммиака
|
| H+ кислая среда | Индикаторы: лакмус, метилоранж | Красное окрашивание |
Специфические реакции на некоторые анионы представлены в табл. 6.2
Таблица 6.2
Специфические реакции на некоторые анионы
| Анион | Реактив | Наблюдаемая реакция |
| S042‾ | Ва2+ | Ва2+ + S042 ‾ → BaS04 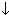 выпадение белого осадка, нерастворимого в кислотах
выпадение белого осадка, нерастворимого в кислотах
|
| N03‾ | Концентрированная H2SO4 и Сu, нагревание смеси | Образование голубого раствора, содержащего ионы Сu2+, выделение газа бурого цвета (NO2) |
| H2S04 +FeSO4 | Возникновение окраски от фиолетовой до коричневой (реакция «бурого кольца») сульфата нитрозо-железа (II) [Fe(H20)5NO]2+ | |
| Раствор дифениламина в концентрированной серной кислоте |
 вещество интенсивного синего цвета
вещество интенсивного синего цвета
| |
| РО43‾ | Ag+ | ЗАg+ + Р043‾ → Аg3Р04 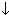 осадок светло-жёлтого цвета
осадок светло-жёлтого цвета
|
| смесь MgCI2, NH4CI и NH4OH (магнезиальная смесь) | HPO42‾ + Mg2+ + NH4OH → MgNH4PO4↓ + H2O белый кристаллический осадок , растворимый в HCI и CH3COOH, но не растворимый в аммиаке | |
| СrO42‾ | Ва2+ | Ва2+ + СrO42‾ → BaCr04 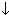 желтый осадок, не растворимый в уксусной кислоте, но растворимый в HCI
желтый осадок, не растворимый в уксусной кислоте, но растворимый в HCI
|
| S2‾ | Рb2+ | Pb2+ + S2‾ → PbS 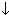 черный осадок
черный осадок
|
Продолжение табл. 6.2
| СО32‾ | Са2+ | Са2+ + С032‾ → СаСОз 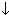 белый осадок, растворимый в кислотах
белый осадок, растворимый в кислотах
|
| Н+ (сильная кислота) | СО32‾ + 2Н+ → Н2О + СО2↑ выделение углекислого газа | |
| SO32‾ | Н+ | 2Н+ + SO32‾ → Н20 + S02↑ характерный запах S02 |
| F‾ | Са2+ | Са2+ + 2F‾ →CaF2↓ белый осадок |
| Cl‾ | Аg+ | Аg+ + Cl‾ → AgCl 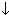 белый осадок нерастворимый в HNO3 , но растворимый в контентрированном растроре аммиака
белый осадок нерастворимый в HNO3 , но растворимый в контентрированном растроре аммиака
|
| Br‾ | Аg+ | Ag+ + Br‾ = AgBr 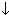 светло-жёлтый осадок нерастворимый в HNO3,темнеет на свету
светло-жёлтый осадок нерастворимый в HNO3,темнеет на свету
|
| J‾ | Аg+ | Аg+ + J‾ 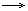 АgJ АgJ 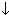 жёлтый осадок нерастворимый в HNO3 и концентрированном NH3, темнеет на свету
жёлтый осадок нерастворимый в HNO3 и концентрированном NH3, темнеет на свету
|
| ОН‾ (щелочная среда) | индикаторы: лакмус фенолфталеин | синее окрашивание малиновое окрашивание |
Пример 1. Для обнаружения в растворе катионов кальция используют …
1) нитрат аммония 2) сульфид аммония 3) оксалат аммония 4) хлорид аммония
Решение: Для обнаружения в растворе катионов кальция используют оксалат аммония:
CaCl2 + (NH4)2C2O4 = СаС2O4↓ + 2NH4C1,
Ca2+ + С2O42- = СаС2O4↓.
Пример 2. Присутствие нитрат-ионов в растворе можно доказать, используя в качестве реактива …
1) магнезиальную смесь 2) дифениламин 3) раствор щелочи 4) раствор иода
Решение.
Добавление нескольких капель раствора дифениламина в концентрированной серной кислоте к раствору, содержащему нитрат-ионы, приведет к появлению синей окраски раствора:
NO3– + дифениламин 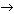 вещество интенсивного синего цвета
вещество интенсивного синего цвета
Дата добавления: 2016-07-27; просмотров: 4236;











