СТРУКТУРНА ОРГАНІЗАЦІЯ БІЛКІВ ТА НУКЛЕЇНОВИХ КИСЛОТ
Структурна організація біополімерів - білків і нуклеїнових кислот - має першочергове значення для розуміння їх функцій в живих організмах, з'ясування молекулярної природи живого. Протягом XX століття був пройдений складний і дуже цікавий шлях у напрямі розкриття структури і функцій біополімерів.
Назвемо лише три визначальні реперні точки на цьому столітньому шляху:
1. У 1902 р. Фішер запропонував поліпептидну теорію структурної організації біополімерів.
2. У 1952 р. Франклін, Крик, Уотсон і Уілкінз експериментально довели, що молекули ДНК, які несуть в собі генетичну інформацію, мають спіральну структуру.
3. На початку 2000 р. американська компанія "Селера Дженомікс" оголосила про завершення основного етапу міжнародної програми "Геном людини", яка має за мету розкриття послідовності нуклеотидів в інформаційних макромолекулах, що, по суті, дає змогу на молекулярному рівні визначити патологічні процеси в організмі людини і розробляти ефективні методи їх запобігання.
Перейдемо безпосередньо до класифікації структурної організації білків і нуклеїнових кислот. Табл. 4.5 містить в собі відомості про чотири види структурної організації біополімерів, типи впорядкування та характер взаємодій, що їм відповідають.
Таблиця 4.5. Структурна організація біополімерів

Первинна структура
Макромолекули білків і нуклеїнових кислот характеризуються чітко відповідною послідовністю мономерів, а саме: в білках - послідовністю амінокислотних залишків в поліпептидному ланцюгу, в нуклеїнових кислотах - послідовністю окремих нуклеотидів в полінуклеотидному ланцюгу. Окремі ділянки цих ланцюгів, тобто поруч розташовані амінокислоти та нуклеотиди, пов'язані між собою дуже сильними хімічними ковалентними зв'язками, величина яких може досягати 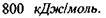 До речі, середня теплова енергія одноатомних молекул при кімнатній температурі
До речі, середня теплова енергія одноатомних молекул при кімнатній температурі  має величину
має величину 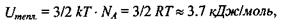 що майже в 220 разів менше, ніж вказана вище енергія зв'язку мономерів в білках та нуклеїнових кислотах.
що майже в 220 разів менше, ніж вказана вище енергія зв'язку мономерів в білках та нуклеїнових кислотах.
Послідовність мономерів (амінокислот в поліпептидному ланцюгу білків та нуклеотидів в полінуклеотидному ланцюгу нуклеїнових кислот) визначає первинну структуру макромолекул. Саме з'ясування первинної структури генетичних макромолекул людини і є головною метою згаданої вище програми "Геном людини", що здавалася фантастичним проектом ще 10 років тому і яка стала дійсністю в 2000 році. І нині вже здаються фантастичними медичні наслідки цієї програми, які можуть стати реальністю через 5-10 років.
Розглянемо більш детально первинну структуру білків, що визначається послідовністю амінокислот. Амінокислоти мають дві частини: 1) однакову для всіх амінокислот пептидну групу; 2) бокову групу (БГ), від якої залежить специфіка амінокислоти. Всього таких різних бокових груп (і відповідно амінокислот) може бути 20. Кожний пептидний блок поліпептидного ланцюга складається з ковалентно пов’язаних атомів  (рис 4.7). До альфа-вуглецевого атома
(рис 4.7). До альфа-вуглецевого атома  приєднується бокова група також за допомогою ковалентного зв'язку. Різні пептидні блоки із своєю боковою групою з'єднуються в поліпептидний ланцюг внаслідок ковалентного зв'язку між атомом вуглецю
приєднується бокова група також за допомогою ковалентного зв'язку. Різні пептидні блоки із своєю боковою групою з'єднуються в поліпептидний ланцюг внаслідок ковалентного зв'язку між атомом вуглецю 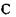 одного пептидного блоку та атомом азоту
одного пептидного блоку та атомом азоту 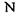 другого пептидного блоку.
другого пептидного блоку.
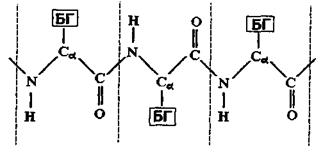
Рис. 4.7. Схема будови поліпептидного ланцюга білкової молекули.
Двадцять амінокислот, що відрізняються своїми боковими групами (амінокислотними залишками), об'єднуються в три класи відповідно до їх фізичних властивостей, що визначаються характером притаманних їм взаємодій. Ця специфіка амінокислот визначає їх просторову структуру, а саме: вторинну, третинну і четвертинну структуру білків.
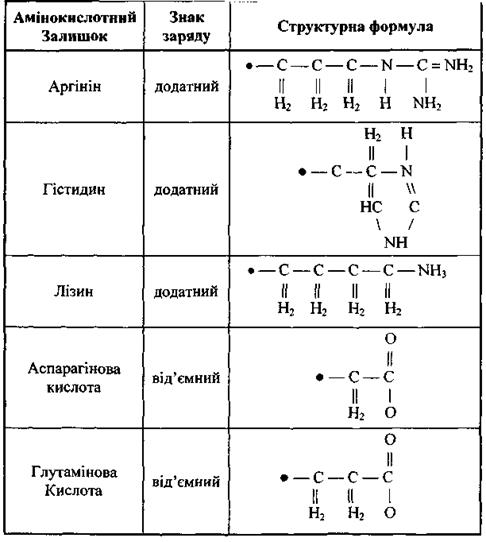
До першого класу віднесемо п'ять заряджених амінокислотних залишків: а) додатно заряджені (аргинін, гістидин, лізин); б) від'ємно заряджені (аспарагінова кислота, глутамінова кислота). У табл. 6.6 наведені структурні формули цих заряджених амінокислотних залишків, що через альфа-вуглецевий атом 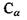 (чорне коло) приєднується до пептидної частини амінокислоти. Амінокислотні залишки першого класу здатні на кулонівські (іон-іонні) та інші електростатичні взаємодії (іон-дипольні, іон-квадрупольні тощо).
(чорне коло) приєднується до пептидної частини амінокислоти. Амінокислотні залишки першого класу здатні на кулонівські (іон-іонні) та інші електростатичні взаємодії (іон-дипольні, іон-квадрупольні тощо).
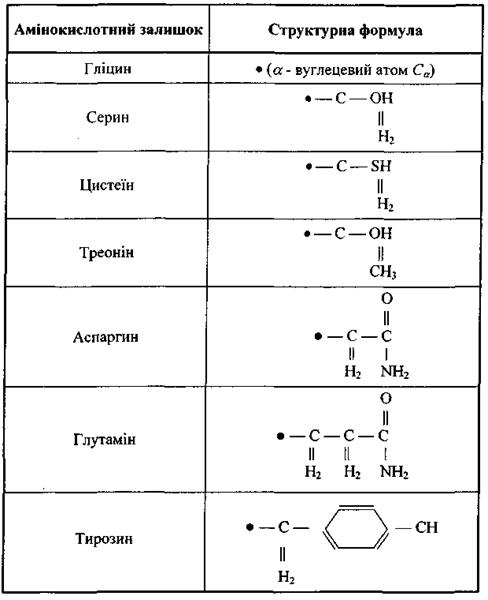
До другого класу відносяться сім полярних амінокислотних залишків, тобто таких, що є, в цілому, електро-нейтральними, але мають дипольний момент через просторове рознесення додатного і від'ємного сумарних зарядів (табл. 4.7). Ці амінокислотні залишки забезпечують диполь-дипольну взаємодію різних типів.
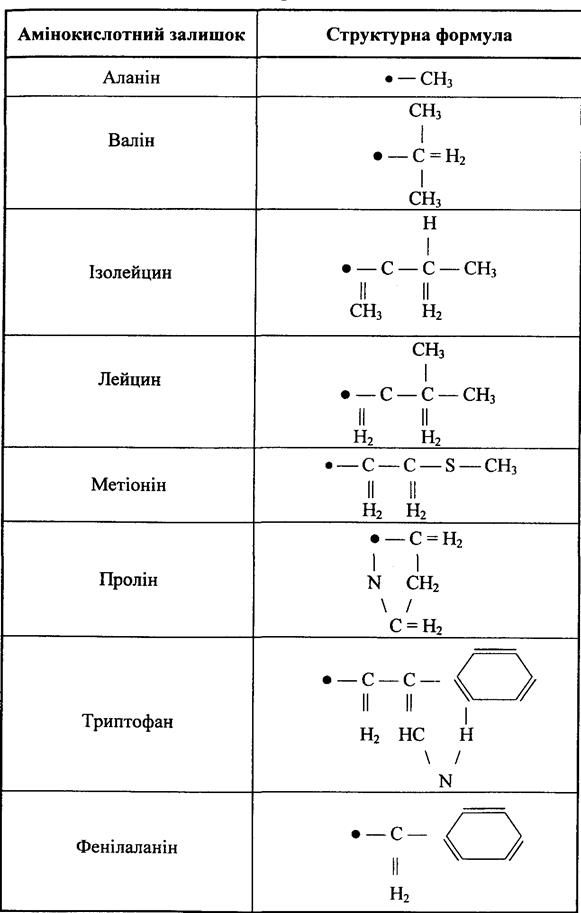
І нарешті, найбільший, третій клас складається з восьми неполярних амінокислотних залишків (табл. 4.8). Для них є характерними ефекти гідрофобної взаємодії.
Первинна структура нуклеїнових кислот визначається послідовністю мономерів (нуклеотидів) в полінуклеїдному ланцюгу. Кожний нуклеотид складається з фосфату і сахару, які пов'язані сильними ковалентними силами і тим самим визначають міцність ланцюга, а також азотних основ двох типів - пуринових (аденін А і гуанін Г) та піримідинових (тимін Т, цитозин Ц і урацил У).
Таблиця 4.6. Заряджені амінокислотні залишки
Таблиця 4.7. Полярні амінокислотні залишки
Видатним досягненням молекулярної біології, яка розвинулася в потужну науку в другій половині XX століття і, безумовно, визначиться як передова наука в XXI столітті, є відкриття та розшифровка генетичної ролі дезоксирибонуклеїнової (ДНК) і рибонуклеїнової (РНК) кислот. Ця роль, коротко кажучи, зводиться до таких процесів:
Таблиця 4.8. Неполярні амінокислотні залишки
1) транскрипція - процес, внаслідок якого інформація, що записана в ДНК, переписується в РНК і передається до рибосомів;
2) трансляція - процес синтезу білків відповідно до інформації, що записана в матричній РНК;
3) білково-нуклеїнове розпізнавання - процес, внаслідок якого вільні амінокислоти приєднуються за допомогою транспортної РНК, яка їх впізнає, до поліпептидного білкового ланцюга.
Вторинна структура
Завдяки використанню прецизійного фізичного методу рентгеноструктурного аналізу вчені відкрили вторинну структуру макромолекул, яка полягає в тому, що поряд з лінійними ділянками в біополімерах були знайдені також ділянки, певним чином скручені в спіраль або в якусь іншу конформацію. Це явище локального впорядкування біопо-лімерних лацюгів було відкрито як для білків (Астбюрі, Полінг, Корі та інші; саме Полінг отримав Нобелівську премію за відкриття цієї тонкої структури білків), так і для нуклеїнових кислот (вже згадане вище відкриття спіральної структури ДНК Франкліном, Криком, Уотсоном і Уілкин-зом).
На рис. 4.8 зображена модель а-спіралі поліпептидного ланцюга білкової молекули, що закручена направо за стрілкою годинника. Основна причина утворення вторинної структури - це наявність водневих зв'язків між амінокислотними залишками. Виявилося, що на кожний крок спіралі приходиться 3.6 амінокислотних залишки, а через п'ять кроків спіралі (ця ділянка містить відповідно 18 амінокислот) конфігурація поліпептидного ланцюга повторюється. Просторовий період повторення  спіралі складає
спіралі складає 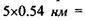
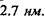 Напрямок водневих зв'язків в
Напрямок водневих зв'язків в  спіралі виявився паралельним до вісі спіралі. Стабілізація спіральної конформації відбувається завдяки водневим зв'язкам між групами
спіралі виявився паралельним до вісі спіралі. Стабілізація спіральної конформації відбувається завдяки водневим зв'язкам між групами 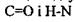 кожної першої і четвертої пептидної одиниці.
кожної першої і четвертої пептидної одиниці.
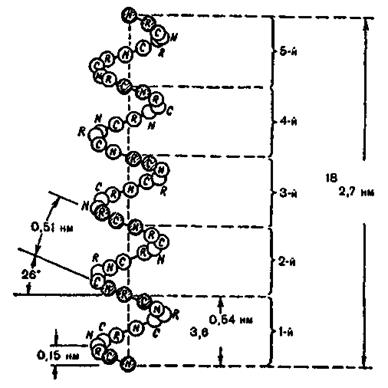
Рис. 4.8. Модель 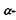 спіралі білкової молекули.
спіралі білкової молекули.
Полінг і Корі встановили, що окрімі 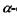 спіралі в білках існують ще інші стійкі конформації поліпептидного ланцюга (наприклад, паралельна і антипаралельна
спіралі в білках існують ще інші стійкі конформації поліпептидного ланцюга (наприклад, паралельна і антипаралельна 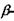 форми тощо). Всі ці стійкі конформації поліпептидного ланцюга, що визначають вторинну структуру білків, зобов'язані своїм існуванням і стабільністю, як і у випадку спіралі, водневим зв'язкам
форми тощо). Всі ці стійкі конформації поліпептидного ланцюга, що визначають вторинну структуру білків, зобов'язані своїм існуванням і стабільністю, як і у випадку спіралі, водневим зв'язкам 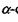 .
.
Вторинна структура нуклеїнових кислот (зокрема, ДНК) пов'язана, як вже згадувалося, з наявністю подвійної спіралі, яка складається з двох полінуклеотидних ланцюгів. У цих взаємно перевитих спіральних ланцюгах пуринові азотисті основи одного ланцюга з'єднані водневими зв'язками з відповідними піримідиновими азотистими основами другого ланцюга. З'єднання азотистих основ відбувається за таким правилом Чаргаффа: незважаючи на те, що кількість азотистих основ А, Г, Т, Ц може змінюватися
досить в широких межах від виду до виду, але завжди кількість пуринових основ в точності дорівнює кількості піримідинових основ. Точніше кажучи, аденін і гуанін в одному ланцюгу пов'язані у строгій відповідності з тиміном і цитозином в другому ланцюгу, утворюючи так звані "уотсон-криківські пари" АТ і ГЦ (рис. 4.9).
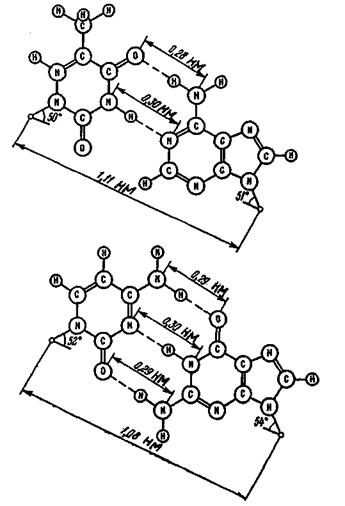
Рис. 4.9. "Уотсон-криківські пари" в подвійній спіралі ДНК.
Слід зазначити, що в парах азотистих основ АТ і особливо в парах ГІД значна роль належить диполь-диполь-ним (Ван-дер-Ваальсівським) взаємодіям. Ці взаємодії стають дуже помітними, коли подвійна спіраль розділяється з утворенням двох окремих ланцюгів. При цьому водневі зв'язки між азотистими основами замінюються на зв'язки з молекулами води.
Температура плавлення ДНК 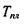 може бути апроксимо-вана такою формулою:
може бути апроксимо-вана такою формулою:
де  - температура плавлення відповідно до пар ГЦ і АТ, а х - концентрація (мольна частка) пар ГЦ в ДНК.
- температура плавлення відповідно до пар ГЦ і АТ, а х - концентрація (мольна частка) пар ГЦ в ДНК.
Окремі (розділені) поліпептидні ланцюги скручуються в клубки. Цей процес називають фазовим переходом спіраль-клубок, або денатурацією. Він відбувається не лише при нагріванні, а й при додаванні кислот, спиртів та деяких інших хімічних сполук.
Третинна структура
Під третинною структурою білків і нуклеїнових кислот, звичайно, розуміють спосіб просторової укладки поліпептидних і полінуклеотидних ланцюгів в 3-вимірному об'ємі. Відповідь на запитання, як організована третинна структура біополімерів, вимагає застосування прецизійних експериментальних методів дослідження (зокрема, методів рентгеноструктурного аналізу, електронної мікроскопії тощо) та сучасних комп'ютерних технологій обробки цих експериментальних даних.
Уперше третинна структура білкової молекули була визначена Дж. Кендрю для міоглобіна кита-кашалота. Цей білок, що містить в собі 153 амінокислотних залишків, відповідає за перенос кисню в м'язах. Виявилося, що третинна структура поліпептидного ланцюга міоглобіну має вигляд скрученої трубки, що досить щільно укладена навколо гема (рис. 4.10).

Рис. 4.10. Третинна структура Рис. 4.11. Третинна структура білкової молекули міоглобіну. ДНК в еукаріотичних клітинах.

Рис. 4.12. Вплив взаємодій на просторове впорядкування білків.
Що стосується нуклеїнових кислот, то зараз досить багато відомо щодо третинної структури певних типів ДНК та РНК. На рис. 4.11 зображено просторове впорядкування ДНК в еукаріотичних клітинах. Видно, що основний елемент третинної структури утворений своєрідним "соленоїдом", який складається з трьох великих витків, що мають діаметр близько 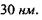
Характер взаємодій, що забезпечують просторове впорядкування білків, ілюструє рис. 4.12. Стабілізація третинної просторової структури здійснюється як за рахунок ковалентних зв'язків та кулонівських (іон-іонних) взаємодій, так і за рахунок нековалентних зв'язків (водневих, дисперсійних, гідрофобних).
Дата добавления: 2020-11-18; просмотров: 692;











