КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температура, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции (V) измеряют по убыли количества субстрата или приросту продукта за единицу времени.
При ферментном катализе фермент (Е) обратимо соединяется с субстратом (S), образуя нестойкий фермент-субстратный комплекс (ES), который в конце реакции распадается с освобождением фермента (Е) и продуктов реакции (Р):
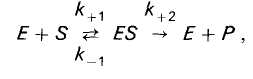
Важная особенность ферментативных реакций – насыщение фермента субстратом. При низкой концентрации субстрата скорость реакции прямо пропорциональна его концентрации. При высокой - скорость реакции максимальна, становится постоянной и не зависящей от концентрации субстрата [S] и целиком определяется концентрацией фермента (рис. 11).
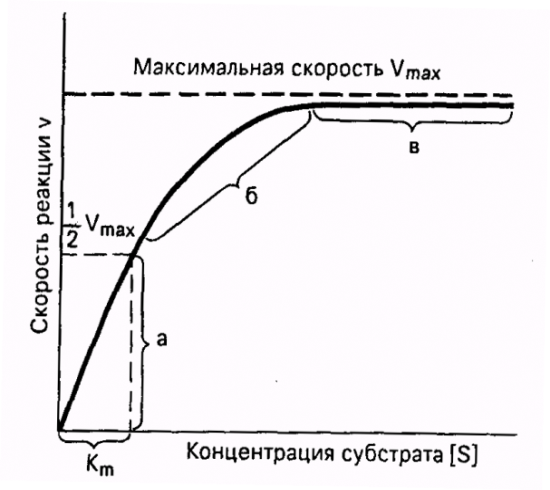
|
| Рис. 11. Зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента. |
KS – константа диссоциации фермент-субстратного комплексаES, обратна константе равновесия:
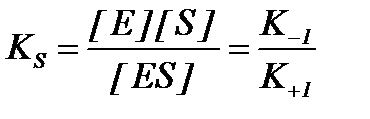
Чем меньше значение KS, тем выше сродство фермента к субстрату.
Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражает уравнение Михаэлиса-Ментен:
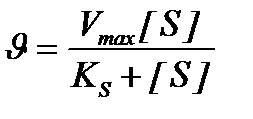 ,
,
u - скорость реакции, Vmax - максимальная скорость ферментативной реакции.
Бриггс и Холдейн усовершенствовали уравнение, введя в него константу Михаэлиса KM, определяемую экспериментально.
Уравнение Бриггса – Холдейна: 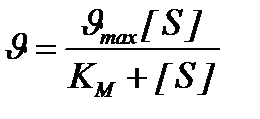
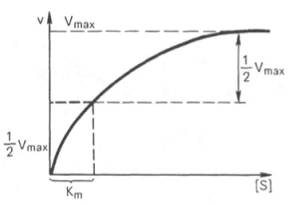
Константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость ферментативной реакции составляет половину от максимальной (рис. 12). Кm показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство.
Экспериментальные значения Кm для большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М. Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции.
|
| Рис. 12. Графическое определение константы Михаэлиса. |
СВОЙСТВА ФЕРМЕНТОВ
Ферменты отличаются от обычных катализаторов рядом свойств.
Термолабильность, или чувствительность к повышению температуры (рис. 13).
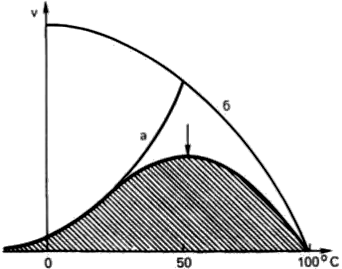
Рис. 13. Зависимость скорости ферментативной реакции от температуры.
При температуре, не превышающей 45–50°С, скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С (правило Вант-Гоффа). При температуре выше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса.
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом.Температурный оптимум для большинства ферментов млекопитающих лежит в пределах 37—40°С. При низких температурах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля.
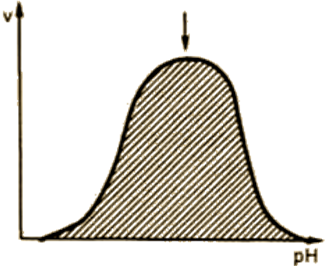
Зависимость активности фермента от значения рН среды(рис. 14).
Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. рН-оптимум действия ферментов лежит в пределах узкой зоны концентрации водородных ионов, соответствующей для животных тканей выработанным в процессе эволюции физиологическим значениям рН среды 6,0-8,0. Исключения составляют пепсин – 1,5-2,5; аргиназа – 9,5-10.
Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на третичную структуру белка.
|
| Рис. 14. Зависимость скорости ферментативной реакции от рН среды. |
Специфичность.Высокая специфичность действия ферментов обусловлена конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими избирательность протекания реакции.
Абсолютная специфичность –способностьфермента катализировать единственную реакцию. Например, уреаза катализирует реакцию гидролиза мочевины до NH3 и СО2.
Относительная (групповая) специфичность – способность фермента катализировать группу реакций определенного типа. Относительной специфичностью, например, обладают гидролитические ферменты пептидазы, гидролизующие пептидные связи в молекулах белков и пептидов.
Стереохимической специфичностьюобладают ферменты, катализирующие превращения только одного из пространственных изомеров. Фермент фумараза катализирует превращение в малат только транс-изомера фумарата и не действует на цис-изомер малеиновую кислоту.
Высокая специфичность действия ферментов обеспечивает протекание лишь определенных химических реакций из всех возможных превращений.
Дата добавления: 2016-07-27; просмотров: 3368;











