Рівняння стану ідеального газу
Стан деякої маси ідеального газу визначається значеннями трьох параметрів : тиску р, об'єму V і температури T. Ці параметри закономірно пов'язані один з одним, таким чином, що зміна одного їх призводить до зміни інших.
Співвідношення, що дають зв'язок між параметрами будь-якого тіла, називається рівнянням стану цього тіла.
Рівняння, що встановлює зв'язок між тиском, об'ємом і температурою ідеального газу було отримано в середині XIX століття французьким фізиком Б. Клапейроном.
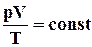 . (2.2)
. (2.2)
Відповідно до закону, встановленого Авогадро, коли кількість речовини газу ν дорівнює 1 моль:
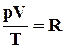 . (2.3
. (2.3
Величина R називається універсальною газовою сталою. Її чисельне значення в СІ становить:
R = 8,31 Дж/моль·К.
Для довільної маси газу рівняння Клапейрона можна записати у виді:
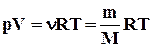 . (2.4)
. (2.4)
У формі (2.4) воно було уперше записане Д. Менделєєвим. Тому рівняння стану газу називається рівнянням Клапейрона-Менделєєва.
Якщо температура газу становить Tн=273,15 К (0°С), а тиск рн = 1 атм = 1,013·105 Па, то говорять, що газ знаходиться за нормальних умов. Як випливає з рівняння стану ідеального газу, один моль будь-якого газу за нормальних умов займає один і той же об'єм V0, рівний
V0 = 0,0224 м3/моль = 22,4 дм3/моль.
Для суміші не взаємодіючих газів рівняння стану набирає вигляду
pV= (ν1 + ν2 + ν3 + ..)·RT. (2.5)
де ν1, ν2, ν3 і т. д. - кількість речовини кожного з газів в суміші.
Газові процеси
Слід зазначити, що задовго до того, як рівняння стану ідеального газу було теоретично отримане на основі молекулярно-кінетичної моделі, закономірності поведінки газів в різних умовах були добре вивчені експериментально. Тому рівняння Клапейрона - Менделєєва можна розглядати, як узагальнення дослідних фактів, які знаходять пояснення в молекулярно-кінетичній теорії.
Газ може брати участь в різних теплових процесах, при яких можуть змінюватися усі параметри, що описують його стан (p, V і T). Якщо процес протікає досить повільно, то у будь-який момент система близька до свого рівноважного стану. Такі процеси називаються квазістатичними. У звичному для нас масштабі часу ці процеси можуть протікати і не дуже повільно. Наприклад, розрідження і стискування газу в звуковій хвилі відбуваються сотні разів в секунду, але цей процес можна розглядати як квазістатичний. Квазістатичні процеси можуть бути зображені на діаграмі станів (наприклад, в координатах p, V) у вигляді деякої лінії, кожна точка якої представляє рівноважний стан.
Інтерес представляють процеси, в яких один з параметрів (p, V або T) залишається незмінним. Такі процеси називаються ізопроцесами.
Ізотермічний процес (T = const)
Ізотермічним процесом називають процес, що протікає при постійній температурі T. З рівняння стану ідеального газу виходить, що при постійній температурі T і незмінній кількості речовини в посудині добуток тиску p газу на його об'єм V повинен залишатися постійним:
рV = const. (2.6)
Графічно (в координатах p, V) ізотермічні процеси зображають сімейством гіпербол p ~ 1/V, які називаються ізотермами. Оскільки коефіцієнт пропорційності в цьому співвідношенні збільшується із зростанням температури, ізотерми, що відповідають вищим значенням температури, розташовуються на графіці вище за ізотерми, що відповідають меншим значенням температури (рис. 2.24). Рівняння ізотермічного процесу було отримане експериментально англійським фізиком Р. Бойлем (1662 р.) і незалежно французьким фізиком Е. Маріоттом (1676 р.). Тому це рівняння називають законом Бойля-Маріотта.
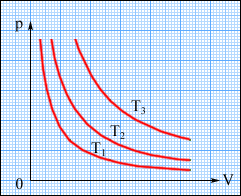
Рисунок 2.24.
Сімейство ізотерм на площині (p, V). T3 > T2 > T1.
Ізохорний процес (V = const)
Ізохорний процес - це процес нагрівання або охолодження газу при постійному об'ємі V і за умови, що кількість речовини в посудині залишається незмінною.
Як випливає з рівняння стану ідеального газу, за цих умов тиск газу pзмінюється прямо пропорціональний його абсолютній температурі: p ~ T або
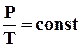 . (2.7)
. (2.7)
На площині (p, T) ізохорні процеси для заданої кількості речовини при різних значеннях об'єму V зображуються сімейством прямих ліній, які називаються ізохорами. Більшим значенням об'єму відповідають ізохори з меншим нахилом по відношенню до осі температур (рис.2.25).
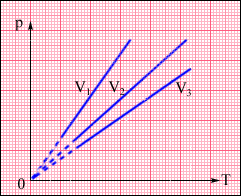
Рисунок 2.25.
Сімейство ізохор на площині (p, T). V3 > V2 > V1.
Експериментально залежність тиску газу від температури досліджував французький фізик Ж. Шарль (1787 р.). Тому рівняння ізохорного процесу називається законом Шарля.
Рівняння ізохорного процесу може бути записане у виді:
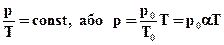 . (2.8)
. (2.8)
де p0 - тиск газу при T = T0 = 273,15 К (0°С). Коефіцієнтα, рівний (1/273,15) К-1, називають температурним коефіцієнтом тиску.
Ізобарний процес (p = const)
Ізобарним процесом називають процес, що протікає при незмінному тиску p.
Рівняння ізобарного процесу для деякої незмінної кількості речовини має вигляд:
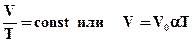 . (2.9)
. (2.9)
де V0 - об'єм газу при температурі 0°С. Коефіцієнт α рівний (1/273,15) К-1. Його називають температурним коефіцієнтом об'ємного розширення газів.
На площині (V, T) ізобарні процеси при різних значеннях тиску p зображуються сімейством прямих ліній (рис. 2.26), які називаються ізобарами.
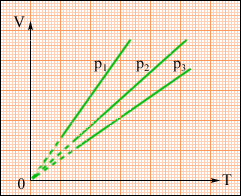
Рисунок. 2.26.
Сімейство ізобар на площині (V, T). p3 > p2 > p1.
Залежність об'єму газу від температури при незмінному тиску була експериментально досліджена французьким фізиком Ж. Гей-Люссаком. (1862 р.). Тому рівняння ізобарного процесу називають законом Гей-Люссака.
Експериментально встановлені закони Бойля-Маріотта, Шарля і Гей-Люссака знаходять пояснення в молекулярно-кінетичній теорії газів.
Приклади розв’язку завдань :
1. Об'єм газу під тиском 6,4·105Па і температурі 288 К дорівнює 0,6 м3. При якій температурі та ж маса газу займе об'єм 1,6м3, якщо тиск стане рівним 2,25·105Па?
Дано:

 P1=6,4·105 Па. Оскільки маса газу не змінилася,
P1=6,4·105 Па. Оскільки маса газу не змінилася,
T1=288 K можна записати . З цього рівняння
 V1= 0,6 м3
V1= 0,6 м3
P2=2,25·105 Па. .
V2= 1,6 м3
 Т2- ? Т2=2,25·105 ·1,6·288/6,4·105·0,6= 270К Ответ:Т2=270К.
Т2- ? Т2=2,25·105 ·1,6·288/6,4·105·0,6= 270К Ответ:Т2=270К.
1. Балон об’ємом 0,1 м3 містить 6 кг кисню. При якій температурі виникає небезпека вибуху, якщо балон витримує тиск 5·106 Па. Молярна маса кисню 3,2·10-2 кг/моль.
Дано:
 P=5·106 Па Запишемо рівняння стану ідеального газу
P=5·106 Па Запишемо рівняння стану ідеального газу
V=0,1 м3 PV=νRT.
m= 6кг. Кількість молей представимо
М=3,2·10-2 кг/моль ν=m/M = 6кг/0,032кг/моль = 187,5 моль.
 Т- ? Тоді Т=PV/νR =5·106 Па·0,1м3/187,5моль·8,31Дж/моль·К≈320 К.
Т- ? Тоді Т=PV/νR =5·106 Па·0,1м3/187,5моль·8,31Дж/моль·К≈320 К.
Відповідь: небезпека вибуху виникає при температурі 320К.
Дата добавления: 2020-10-25; просмотров: 753;











