Електрокінетичні властивості колоїдних систем
Колоїдні системи характеризуються електрокінетичними властивостями.
Рух частинок дисперсної фази в електричному полі до протилежно зарядженого електрода називається електрофорезом. Електрокінетичні ефекти можна спостерігати також і при русі одної фази відносно іншої.
В лабораторних умовах електрофорез застосовують для визначення знаку заряду колоїдних частинок.
Позитивні заряди мають частинки колоїдів гідроксидів Феруму, Алюмінію, Хрому, TiO2, деяких індикаторів.
Прикладами від’ємно заряджених частинок можуть бути золі металів Au, Ag, Pt, Sb, Cu і сульфідів деяких металів, кислотні барвники і ін.
Між електролізом в розчинах електролітів і електрофорезом в колоїдних системах є багато спільного. До одного з електродів рухаються колоїдні частинки з адсорбованими на них йонами, а до другого – протийони зовнішнього шару; швидкості переміщення колоїдних частинок та йонів мають величину одного і того ж порядку.
Маса колоїдних частинок дуже велика у порівнянні з масою йонів. Тому електрофорез на відміну від електролізу довгий час вважали одностороннім процесом бо звертали увагу тільки на той електрод, де виділялась речовина колоїда, не помічаючи через дуже малу масу протийонів, що виділились на протилежному електроді.
На межі розділу двох фаз різного хімічного складу відбувається перерозподіл електричного заряду, пов'язаний з переходом заряджених частинок (йонів, електронів) з одної фази в іншу. Таким чином, на межі розділу фаз виникає подвійний електричний шар.
Причини і механізм утворення електричного заряду на поверхні можуть бути різними: перехід катіонів металу в розчин; контакт двох неоднакових розчинів електролітів чи двох рідин, які не змішуються, з розподіленими в них йонами; адсорбція на поверхні йонів з розчину; дисоціація утворених поверхневих сполук на межі розділу тверда фаза – рідина та ін.
Виникнення подвійного шару призводить до встановлення між фазами різниці потенціалів, величина якої залежить від властивостей обох фаз.
При невеликій щільності заряду в сильно розведених розчинах зовнішня обкладинка подвійного шару завдяки молекулярному тепловому руху та відштовхування йонів набуває дифузної будови подібно розподіленню молекул газу в гравітаційному полі, що описується законом Лапласа. Товщина дифузного шару збільшується із зменшенням заряду йонів та концентрації розчину аналогічно тому, як змінюється дифузна атмосфера протийонів навколо кожного окремого йона або поблизу зарядженої межі двох фаз у відповідності з теорією сильних електролітів Дебая-Гюккеля. Щільність об’ємного заряду та концентрація йонів поступово зменшуються в міру віддалення від поверхні, наближаючись до рівноважної концентрації в глибині розчину.
Було встановлено, що для не дуже розведених розчинів подвійний шар складається з двох частин: внутрішньої – щільної і зовнішньої – дифузної. Внутрішня частина подвійного шару складається з двох рядів йонів, що близько розташовані один біля іншого на деякій постійній відстані порядку розміру одного йона. Перший ряд йонів міцно зв’язаний з поверхнею твердої фази і визначає її заряд; тому йони першого ряду називаються потенціалвизначальними. Другий ряд йонів протилежного знаку щільно прилягає до першого завдяки електростатичним силам притяжіння та специфічної адсорбції з боку поверхні. Адсорбційний шар не є в цілому електронейтральним, так як кількість зарядів йонів другого ряду не співпадає з числом зарядів йонів першого ряду через специфічність адсорбції аніонів і катіонів. Кількість зарядів, яких не вистачає для компенсації потенціалвизначальних йонів, розташовується у зовнішній, дифузній частині всього подвійного шару, яка зв’язана в більшій мірі з рідкою фазою (розчином) (рис.1).
Якщо φ – загальна різниця потенціалів між фазами, φ0 – стрибок потенціалу в щільній частині, φ1 – стрибок потенціалу в дифузній частині, то, очевидно:
φ = φ0 + φ1.
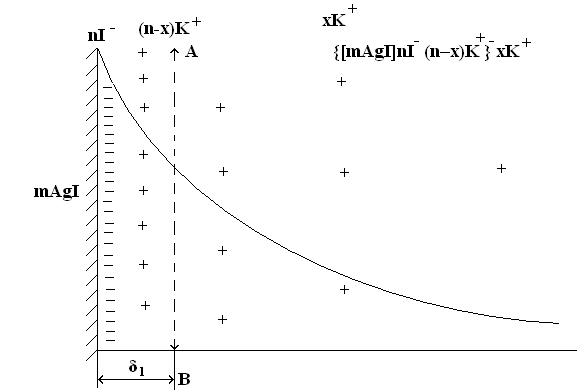
Рис. 1. Схема розподілення зарядів і потенціалу в міцелі золя AgI
mAgI – ядро;
nI– – кількість йонів І–, які міцно адсорбовані на поверхні ядра –
потенціалвизначальні;
(n–x)К+ – частина протиіонів, що входять в адсорбційний шар;
x К+ – кількість протиіонів зовнішнього, дифузного шару йонів;
δ1 – товщина адсорбційного шару;
АВ – межа між адсорбційною та дифузною частинами подвійного
електричного шару.
Електрокінетичні явища в колоїдних системах, пов’язані з відносним переміщенням фаз, мають пряму залежність від заряду частинок та від йонів дифузної частини подвійного шару, які беруть участь у русі рідкої фази. З теорії будови подвійного шару випливає, що рух (плав) рідини йде не по твердій поверхні колоїдної частинки безпосередньо, а дещо далі, за межами нерухомого (адсорбційного) шару на деякій відстані від поверхні. Ця участь йонів у русі рідини характеризується падінням потенціалу в межах дифузного шару, тобто частиною загального потенціалу φ1. Різниця потенціалів між рухомою (дифузною) та нерухомою (адсорбційного) частинами подвійного електричного шару називається електрокінетичним потенціалом або дзета-потенціалом. У сильно розведених розчинах дзета-потенціал наближується до значення φ1-потенціалу.
На твердій поверхні можуть адсорбуватися не тільки йони, що визначають потенціал, але і інші йони, що є у розчині. Отже рідку обкладку подвійного шару можуть створювати йони різного типу.
Дата добавления: 2020-10-14; просмотров: 577;











