Моиоклональные антитела как лекарственные средства
Молекула антитела (иммуноглобулина) состоит из двух «легких» (L) и двух «тяжелых» (Н) белковых цепей, которые соединены водородными связями и дисульфидными мостиками, расположенными в строго определенных местах. N-концевые участки L и Н-цепей образуют антигенсвязывающий сайт, отдельные области (домены) молекулы антитела выполняют разные функции. Антигенсвязывающие сайты состоят из трех участков, определяющих комплементарность антител к антигену (СDR.) и образующих вариабельные области (Vн и V1) на N-концах Н- и L-цепей. Кроме вариабельных (Vн и V1) каждая L-цепь содержит одну константную область или домен (СО, каждая Н-цепь -три константных области или домена (СН1 СН2, СН3)- При обработке антитела протеолитическим ферментом - папаином —образуются три фрагмента: два идентичных (Fab), каждый из которых содержит интактную L-цепь, связанную дисульфидным мостиком с Vн и Сн1 - до-менами Н-цепи, и один Fc, состоящий из двух соединенной дисульфид-ной связью с Сн2 и Снз - доменов Н-цепи.
Fab-фрагмент, точнее его N-концевая часть, называемая Fv-фраг-ментом, обладает антигенсвязывающей активностью, присущей ин- . тактной молекуле антитела.
После связывания антигена с интактным антителом запускаются реакции иммунного ответа:
1.Активируется система комплемента; компоненты этой системы разрушают клеточные мембраны, активируют фагоциты и генерируют сигналы, мобилизующие другие компоненты системы иммунного ответа.
2.В результате связывания Fc-участка антитела с Fс-рецептором эффекторной клетки, запускается реакция опосредованной антителами клеточной цитотоксичности. Активированная эффек-торная клетка высвобождает вещества, лизирующие чужеродную клетку, с которой связан РаЬ-участок молекулы антитела.
3.После связывания РаЬ-участка с растворимым антигеном, Рс-участок антитела может присоединиться к рецепторам фагоцитов, которые захватывают и разрушают комплекс антиген - антитело.
Для облегчения доставки лекарственного вещества (ЛВ) к месту его действия используют несколько приемов:
• Заключают в липосомы, липидная оболочка которых имеет высокое сродство к клеткам нужных органов.
•Встраивают гены специфических токсинов в инфильтрующие опухоль лимфоциты, которые высвобождают эти токсины непосредственно в опухоли.
• Присоединяют молекулы ЛВ к моноклональным антителам или их Fv-фрагментам, специфичным по отношению к белкам, находящимся на поверхности строго определенных клеток, например опухолевых (рис. 13, A).
• Используют ЛВ в неактивной форме, переводя их в активное состояние при помощи ферментов. Чтобы такое превращение происходило только вблизи клетки-мишени, фермент присоединяют к моноклональному антителу, специфичному к поверхностному антигену этой клетки (рис. 13, Б).
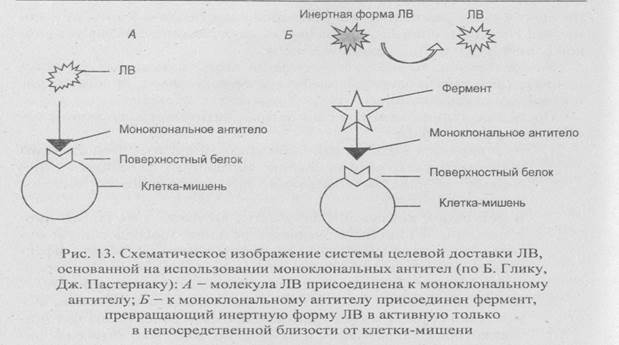
В обоих случаях моноклональное антитело связывается с одним специфическим белком на поверхности клетки-мишени.
6.2. Тромболитики и антикоагулянты
Система свертывания крови состоит из тромбоцитов и содержащихся в них пластиночных факторов (аденозиндифосфата), тканевого тром-бопластина, серотонина, антиплазмина, фибронектина, тромбоспондина и др.), плазменных белков, синтезирующихся в клетках печени (протромбина, проконвертина, антигемофильных глобулинов, тромботро-пина, фибриногена и др.).
Антисвертывающая система представлена плазмином (фибриноли-зином) - протеолитическим ферментом, находящимся в крови в неактивном состоянии (плазминоген), белками плазмы крови (протеинами С, 8, антитромбином III, тормозящими процесс образования фибрина, а также веществами, продуцируемыми (простациклин, тромбомодулин и др.) или фиксированными на эндотелиальных клетках (гепарин). При нарушении равновесия между этими двумя системами может возникать или повышенная кровоточивость, или тромбообразование, или сочетание того и другого.
Наиболее частой причиной смерти являются тромбоэмболия мозговых или сердечных артерий. Известно, что тромб состоит из молекул фибрина, фактора свертывающей системы крови, образующего сеть в ответ на повреждение сосудистой стенки. В норме молекулы фибрина в образовавшемся тромбе расщепляются ферментом, способствующим растворению фибрина in vivo, - сериновой протеиназы плазмина, который образуется из плазминогена под действием активатора (рис. 14).

Рис. 14. Активация плазминогена с превращением его в плазмин и разрушение плазмином двух субстратов (фибриногена и фибрина) в крови
Нередко эта биологическая система работает недостаточно эффективно, что приводит к закупорке артерий. В таких ситуациях для повышения уровня плазмина в крови было предложено использовать активатор плазминогена (АПг) в качестве терапевтического средства. Однако плазмин способен разрушать и предшественник фибрина - фибриноген (рис. 15), и если уровень фибриногена в результате терапии с использо-
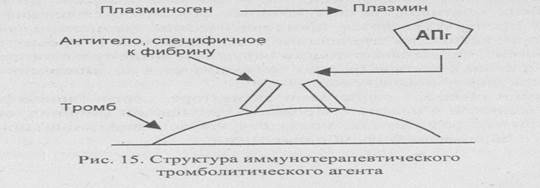
ванием АПг значительно снизится, могут произойти обширные внутренние кровотечения.
К моноклональному антителу, специфичному к фибрину, присоединен АПг. Этот комплекс связывается с фибрином, находящимся в тромбе, АПг вызывает накопление плазмина вблизи тромба, и плазмин лизи-рует тромб.
Тромболитическая терапия, осуществляемая активаторами плаз-миногена тканевого типа (ТАПг), широко используется при лечении острого инфаркта миокарда, закупорки мозговых и коронарных артерий, эмболии легких.
Плазминоген человека представляет собой одноцепочечный глико-протеин м.м. 90000; его содержание в плазме составляет примерно 2 мкмоля/л. Плазминоген обладает способностью превращаться в плазмин с помощью природных активаторов плазминогена, находящихся в небольшом количестве в органах и тканях, либо с помощью бактериальной стрептокиназы. Одно из основных свойств АПг - способность участвовать в процессе фибринолиза. Эти ферменты, представляющие собой естественные тромболитические агенты, имеют огромное значение в борьбе с коронарными и церебральными тромбозами и тромбозами сосудов легких.
Активирование плазминогена стептокиназой заключается в образовании на начальной стадии комплекса плазминоген - стрептокиназа, обладающего способностью активировать молекулу плазминогена; этот комплекс затем с помощью ферментативного механизма обеспечивает превращение плазминогена в плазмин.
Плазмин (фибринолизин) является эндопептидазой широкого спектра действия. Как плазминоген, так и плазмин содержат по пять ди-сульфидных мостиков, за счет которых формируются специфические домены. Препарат является протеолитическим ферментом, образующимся при активации трипсином содержащегося в крови человека плазминогена. Он вызывает только наружный лизис тромба (преимущественно в венах), так как быстро нейтрализуется антиплазмином, в избытке циркулирующим в крови.
Плазмин обладает свойствами активатора, переводящего эндогенный плазминоген в плазмин. Продукты деградации фибрина, образующиеся при его разрушении, препятствуют полимеризации мономеров фибрина и образованию тромбопластина.
Однако плазмин может вызвать активацию свертывающей системы крови и повысить антифибринолитические свойства крови. Поэтому его вводят с гепарином.
Генерируемый активатором плазминогена плазмин кроме растворения тромбов способен стимулировать • деление клеток, видоизменять клеточные поверхности, активировать специфические протеазы, превращать проинсулин и проадренокортикотропин в инсулин и АКТГ соответственно.
С учетом м.м., энзиматических и серологических свойств, способности связывать фибрин плазмы крови АПг принято делить на активаторы тканевого и урокиназного типов.
Активаторы плазминогена тканевого типа. Содержание ТАПг широко варьирует в различных органах тканей: препарат, полученный из ткани матки человека, характеризуется м.м. 690.00 и состоит из двух полипептидных цепей с м.м. 31000 и 38000; фермент, экстрагированный из клеток сосудов трупа человека, имеет м.м. 60000 и состоит из двух близких по размеру полипептидов. Природный ТАПг может существовать как в виде протеолитически деградируемой двухцепочечной, так и одноцепочечной формы.
Получают природный ТАПг методом культивирования клеток. Основной источник получения препарата - линия клеток меланомы человека; такой фермент - мТАПг характеризуется м.м. 72000 и, в зависимости от условий культивирования и очистки, может быть получен в одно- и двухцепочечной форме. Для очистки ТАПг, полученного из культуры клеток меланомы, применяют аффинную хроматографию с использованием пяти аффинных сорбентов: конканавалина А, п-аминобензамидина, имидинодиуксусной кислоты, борной кислоты, лизина - все марки 5PW.
Метод получения рекомбинантного ТАПг (рТАПг) разработан в 80-х гг. XX в. Ген ТАПг расположен у человека в хромосоме 8. Технологи клонирования и экспрессии рТАПг в клетках Е. coli, S. cerevisiae и клетках животных позволили получать ТАПг в промышленных масштабах, провести широкое клиническое изучение и выйти на мировой рынок тромболитиков.
Сравнительное изучение мТАПг и рТАПг в отношении тромболизи-са при инфаркте миокарда и других типов тромбозов показало полную идентичность их биологических тромболитических свойств. Лидерами в области разработки рТАПг (альтеплазы) являются фирмы «Genentech» и «Boehringer Ingelheim», выпускающие альтеплазу под торговыми названиями activase и actilyse.
Активаторы плазминогена урокиназного типа. Урокиназа — активатор плазминогена, содержащийся в моче человека, состоит из двух полипептидных цепей (А и В), соединенных между собой дисульфид-ным мостиком, встречается в высоко- и низкомолекулярной формах (м.м. соответственно 55000 и 34000).
Препарат получают из культуры клеток эмбриона почки человека. Урокиназа активирует плазминоген, превращая его в плазмин. Фибри-нолитический эффект наступает быстрее, чем от стрептокиназы. Препарат способен активировать фибринолиз внутри тромба (эндотромболиз) и на его поверхности (экзотромболизис). По клинико-фармакологичес-кой характеристике урокиназа близка к стрептокиназе. Урокиназа не обладает выраженными антигенными свойствами, поэтому при ее использовании меньшая опасность возникновения аллергических реакций и ее назначают повторно.
Одноцепочечная форма урокиназы получила название проурокина-зы. Проурокиназа является проферментом урокиназы, содержится в различных органах и тканях, включая плазму крови. Проурокиназа — одноцепочечный гликопротеин, состоящий из 411 аминокислот. Гидролиз одной из пептидных связей плазмином способствует ее трансформации в урокиназу.
Большое значение имеет получение активаторов плазминогена урокиназного типа методом генной инженерии. Ген урокиназы/проуро-киназы локализуется у человека в хромосоме 10; продукт экспрессии гена урокиназы, клонированного в Е. coli, содержит одну или две цепи в зависимости от присутствия ингибиторов протеаз в процессе очистки фермента. Оценка биологических и фибринолитических свойств реком-бинантной урокиназы (р-урокиназы), рекомбинантной проурокиназы (р-проурокиназы) и природной урокиназы, выделенной из мочи, показала, что рекомбинантные урокиназа и проурокиназа обладают лучшей тромбоселективностью и вызывают меньшее число побочных явлений, чем урокиназа.
Стрептокиназа - тромболитик прямого действия, является активатором плазминогена, относится к тромболитикам 1 поколения. В очищенном виде стрептокиназа представляет собой пористую массу белого цвета без запаха, легко растворимую в воде, м.м. 40000—50000.
Препарат получают из р-гемолитического стрептококка группы С. Это непрямой фибринолитик. Стрептокиназа стимулирует перевод циркупирующего в крови проактиватора в активатор, трансформирующий плазминоген в плазмин. Препарат способен проникать внутрь тромба и активировать в нем фибринолиз, чем выгодно отличается от плазмина. Продукты распада тромба, циркулирующие в крови, вызывают гипокоагуляцию, блокируют агрегацию эритроцитов и тромбоцитов, снижают
вязкость крови.
Среди тромболитических препаратов стрептокиназа занимает прочную позицию, что обусловлено доступностью получения ее из микробного сырья и относительно невысокой реактогенностью (антитела к стрептокиназе исчезают в течение 6 месяцев; иммунологическая реактогенность этого белка обычно проявляется лишь у лиц с отягощенным анамнезом, например, перенесших стрептококковую инфекцию).
На мировом рынке медикаментов лидируют препараты стрептоки-назы из микробного сырья: кабиказа (фирма «Kabi Vitrum»), стрептаза (фирма «Hoechst»), стрептокиназа (фирма «Smith Kline»).
Фирма «Phillips Petrolium» (США) запатентовала метод экспрессии стрептокиназы в S. cerevisiae. Экспрессируемый в дрожжах белок по м.м. и активности идентичен стрептокиназе, полученной из Streptococcus equisimilis. Метод рекомбинантных ДНК позволил получить высокий выход искомого продукта - 1г/1л среды.
Методом рекомбинантных ДНК получен вектор, несущий ген стрептокиназы, адаптированный для трансформации в бактериальный геном (патент США).
Запатентован метод (Германия) ферментационного получения стрептокиназы; генноинженерным способом получена плазмида, содержащая ген стрептокиназы. Экспрессия стрептокиназы получена трансформацией этой плазмиды в клетки Streptococcus. После ферментации таких клеток из культуральной жидкости выделена и очищена стрептокиназа м.м. 42000.
Стрептодеказа — пролонгированный препарат стрептокиназы, относящийся к группе иммобилизованных ферментов, нанесенных на водорастворимую матрицу полисахаридной природы. Однократное введение средней терапевтической дозы обеспечивает повышение фибрино-литической активности крови в течение 48—72 ч.
Рекомбинантный тканевой активатор плазминогена (актилизе) является гликопротеином (полным аналогом эндогенного вещества, вырабатываемого эндотелием), который после системного введения находится в плазме в неактивной форме до момента связывания с фибрином. После активации препарата он способствует переходу плазминогена в плазмин и ведет к растворению фибринового сгустка, повышая фибри-нолиз только в ткани тромба.
Ацилированный комплекс стрептокиназы и плазминогена (торговое название эминаза) - тромболитик 2-го поколения, разработан и запатентован английской фирмой «Beecham». Ацильная группа, входящая в состав комплекса, защищает тромболитик от инактивации природным ингибитором L2-антиплазмином. По мере поступления eminase в кровяное русло начинается быстрое гидролитическое отщепление ацильной группы, высвобождение активированного комплекса происходит с постоянной скоростью. Комплекс действует почти исключительно на фибрин кровяного сгустка, не затрагивая фибриноген. Наиболее грозное побочное действие тромболитиков — возникновение внезапных кровотечений - проявляется при применении eminase весьма редко. Успех международных клинических испытаний eminase обеспечил признание этого тромболитического средства на мировом рынке.
В качестве тромболитиков предложены химерные (гибридные) молекулы, содержащие домены ТАПг и урокиназы; эти гибридные молекулы характеризуются таким же сродством к фибрину и способностью к лизису тромбов, как и рТАПг. Химерные молекулы получают методом слияния концевой кДНК, кодирующей концевой аминосодержащий фрагмент ТАПг, ответственный за специфичность в отношении фибрина, с кДНК, кодирующей концевой карбоксисодержащий фрагмент проурониказы, ответственный за ферментативные свойства молекулы. Это соединение обладает специфичностью к фибрину, характерной для обеих молекул; лечебная доза этого препарата может быть в 4 раза меньшей, чем доза ТАПг и урокиназы, вводимых отдельно; прямым следствием снижения дозы является уменьшение вероятности возникновения побочного действия.
Сконструированы химерные молекулы, содержащие фрагменты ТАПг, урокиназы и проурокиназы, клонированные в животных клетках (фирма «Ciba-Geigy», Швейцария).
Разработаны генно-инженерные системы доставки тромболитиков (США). Описано строение моноклонального антитела, способного доставить тромболитический белок к месту образования тромба. Гены, ответственные за образование Р-цепи ТАПг, были внедрены в гибридомы, продуцирующие антитела, которые экспрессировали белок, способный избирательно доставляться к месту скопления фибрина, кроме того, такой активированный белок способен активировать плазминоген (фирма «Genentech»).
Антикоагулянты. Гепарин и его производные принадлежат к числу наиболее безопасных препаратов. Гепарин относится к гуморальным факторам регуляции жидкого состояния крови и обладает высокой связующей способностью практически ко всем факторам системы коагуляции. Гепарин нейтрализует действие сериновых протеиназ и фибрино-вых систем за счет образования комплекса антитромбин Ш-гепарин (АТ-Ш-гепарин). Препараты гепарина гетерогенны и содержат фракции с высоким и низким средством связывания с АТ-Ш (АТ-Ш является ингибитором активаторов плазминогена).
В медицинской практике используются препараты низкомолекулярного или фракционного гепарина — логипарин, фраксипарин, далтепа-рин, кливарин. Их относят к гепаринам II поколения. Получают низкомолекулярные гепарины методом ферментативной деполимеризации высокомолекулярного гепарина с помощью бактериальной гепариназы. Гепарин повышает активность фибринолитической системы за счет образования комплекса с антиплазмином. Гепарин накапливается на поверхности эндотелиальных клеток и клеток крови, создавая на их мембранах концентрацию в 100 раз большую, чем в плазме крови. Этим он придает поверхности эндотелия и тромбоцитов отрицательный заряд, препятствуя их адгезии и агрегации, а также высвобождению из них агрегирующих факторов.
Низкомолекулярные гепарины не влияют на коагуляцию, т.е. они не изменяют время свертывания крови, но их терапевтический эффект больше, чем у высокомолекулярных форм. Это свидетельство того, что основное в действии гепарина — ограничение агрегации и адгезии тромбоцитов. Подтверждением данного механизма является и отсутствие корреляции между клинической эффективностью гепарина и увеличением времени свертывания крови.
Антикоагулянт фрагмин (фирма «Kabi Vitrum», Швеция) получают из стандартного гепарина, извлекая из него составную часть, обладающую наибольшей антикоагулянтной активностью. Fragmin имеет достаточно длительный период полураспада, что позволяет применять его в виде однократной подкожной инъекции. Кроме антикоагулянтного и тромболитического действий отмечено его благоприятное влияние на снижение уровня триглицеридов в крови. ВОЗ рекомендовала использовать фрагмин в качестве международного стандарта при оценке лечебного эффекта и безопасности антикоагулянтов нового поколения.
Методом органического синтеза (фирмы «Organon», Нидерланды и «Choy», Франция) получен гепариноид - аналог гепарина; активное начало этого препарата оставляют сульфатированные олигосахариды.
Гирудин - антикоагулянт прямого быстрого действия, это белок, вырабатываемый слюнными железами медицинской пиявки (Hirudo medicinalis), которая в течение ряда лет использовалась для предотвращения тромбоэмболии мелких сосудов. Гирудин является сильным и специфичным ингибитором тромбина и относится к группе противо-свертывающих препаратов прямого быстрого действия, препятствующих образованию и отложению нитей фибрина. Он инактивирует связанный с фибрином тромбин в тромбах. Существует несколько близкородственных вариантов гирудина (HV1,HV2, HV3). Наиболее изучен HV], представляющий белок с м.м. около 7000, состоящий из 65 аминокислотных остатков. Гирудин ингибирует только тромбин и неактивен в отношении трипсина и плазмина. Введение гирудина не влияет на работу сердца, органов дыхания, иммунной системы.
В настоящее время гирудин получают с использованием технологии рекомбинантных ДНК. Ген герудина экспрессирован в S. cerevisiae (фирмы «Francgene», «Sanofi», Франция); для очистки препарата использована ВЭЖХ.
Фирмой «Ciba Geigy» разработан метод экспрессии частично де-сульфатированного варианта гирудина (десульфатогирудина) в S. cerevisiae. Рекомбинантный гирудин с одной отсутствующей сульфо-группой по антикоагулянтной активности превосходит гепарин.
Белки С и S являются важными факторами антикоагулянтной системы. Белок С был впервые описан в 1960 г. как аутопротромбин П-а и лишь в 1976 г. выделен в чистом виде. Белок С-гликопротеин м.м. 62000 состоит из двух субъединиц, связанных дисульфидным мостиком, содержит около 10 аминокислотных остатков у-карбоксиглюта-миновой кислоты.
Белок С является витамин-К-зависимым ингибитором свертывающей системы. Имеются данные, что снижение уровня белка С в крови связано с риском возникновения тромбозов, причем дефицит этого белка бывает наследственным и приобретенным; так, при недостатке белка С может развиться тромбофлебит. Дефицит белка С наблюдается при заболеваниях печени (возможно, синтез белка С происходит в этом органе).
Белок S является кофактором белка С и образует с последним активированный комплекс на поверхности фосфолипидных мембран тромбоцитов, эндотелиальных и других клеток; в результате каталитическая способность белка С возрастает. Белок S также является витамин-К-зависимым и имеет высокое средство к отрицательно заряженным фосфолипидам. Белок S - гликопротеид с м.м. 69000.
Разработана технология получения рекомбинантного белка С (фирма «Eli Lilly») в культуре клеток почек, трансформированной аденовирусом. Очищенный белок на 90% представлен двухпептидным компонентом и на 10% однопептидным, по активности не уступает белку С, находящемуся в плазме крови человека. Генноинженерный препарат белка С предложен для лечения последствий ортопедической и абдоминальный хирургии, легочной эмболии.
Два рекомбинантных гибрида белка С (антикоагулянтной и фибри-нолитической активности) (фирма «Hoechst Japan»), не уступающие белку С из крови человека, предупреждают острый инфаркт миокарда и послеоперационные тромбозы.
В 1982 г. выделен и охарактеризован еще один кофактор активации белка С - тромбомодулин, локализованный в мембране эндотелиальных клеток и являющийся кальций-зависимым ингибитором коагуляции и агглютинации тромбоцитов. Тромбомодулин — неразветвленный глико-протеин с м.м. 68000—77000, содержит 117 аминокислотных остатков. Выделен структурный ген тромбомодулина, ген клонирован с последующей экспрессией в клетках почек обезьяны (фирма «Asahi Chemical», Япония).
Аминокислоты
Аминокислоты широко применяют в медицине для терапии послеоперационных больных, при лечении заболеваний ЦНС, язвенной болезни желудка и двенадцатиперстной кишки, печени (серотонин, аспа-рагин, валин, гистидин, глицин, глутамин и глутаминовая кислота, изо-лейцин, лейцин, метионин, пролин, тирозин, триптофан, фенилаланин, цистеин); в пищевой промышленности в качестве усилителей вкуса и аромата, антиоксидантов и пищевых добавок (аланин, аспарагиновая кислота, глицин, глутаминовая кислота, лизин, цистеин); в сельском хозяйстве - в качестве кормовых добавок (лизин, треонин); в химической промышленности - как исходные вещества при синтезе полимеров и производстве косметических средств.
Ежегодно в мире производится более 800000 т аминокислот стоимостью более 5 млрд долларов; при этом больше половины общего объема производства приходится на долю L-глутаминовой кислоты, которую используют для получения широко известного усилителя вкуса и аромата - натрия глутамата.
В промышленном масштабе аминокислоты получают, в основном, экстракцией из белковых гидролизатов или очисткой продуктов метаболизма двух неспорулирующих грамположительных почвенных бактерий - Corynebacterium или Brevi bacterium spp. Обычно для повышения продуктивности этих микроорганизмов используют мутагенез с последующим отбором штаммов - сверхпродуцентов определенных аминокислот, но такой способ получения штаммов требует много времени и эффективность его невелика. Альтернативные подходы — выделение и изменение специфических генов, кодирующих ключевые ферменты определенных биохимических реакций. Например, генноинженерный способ получения аминокислоты триптофана, синтезируемой С. glutami-cum, одного из видов Corynebacterium. Для этого в клетки С. glutamicum дикого типа введена копия гена, кодирующего антранилатсинтазу, фермента, лимитирующего синтез триптофана.
Высокий уровень биосинтеза триптофана достигают введением в клетки С. glutamicum модифицированных генов трех ключевых ферментов : 3 -дезокси-Д-арабиногептулозонат-7-фосфатсинтазы, антрани-латсинтазы и антранилатфосфорибозилтрансферазы. В качестве альтернативы для синтеза аминокислот можно использовать Е. coli.
Известно, что важным регулятором функций клеток, тканей и органов, осуществляемых через жидкие среды организма, является а2-макроглобупин (МГ). Этот белок способен ингибировать активность протеолитических ферментов, транспортировать цитокины, регулировать процессы эндоцитоза, кооперации различных клеток крови, пре-зентировать микроорганизмы и гены. Из плазмы крови человека очисткой (a2-МГ, сочетающей дробное осаждение полиэтиленгликолем, анио-нообменной и металхелатной аффинной хроматографией, получен на-тивный белок а2-МГ, имеющий уникальные регуляторные свойства, -высокую ингибирующую активность в отношении протеиназ; препарат (НПО «Вектор», Новокузнецкий ГИУВ) показан при воспалительных процессах, передозировках протеиназ, септических состояниях, вызванных микроорганизмами. На основе нативного а2-МГ получены стабильные, имеющие полную биологическую совместимость комплексы с плазмином и интерфероном а-ИФ2. Доставка комплекса а2-МГ-ИФ2 непосредственно в опухоль весьма перспективна в онкологии.
Природные пептиды любого происхождения универсальны, они оказывают защитное действие на организм млекопитающих, стимулируя работу одной из главных систем — иммунной. Ценным сырьем для получения полипептидов являются гидробионты. Первым препаратом гидробионтов был ганглин, полученный в 1981 г. в НПО «Биомед» из ганглиев тихоокеанских кальмаров методом ультрафильтрационной очистки и выделения пептидов. Ганглин содержит 45 пептидных фракций. Иммуномодулирующие свойства ганглина определили его применение для устранения любых вторичных иммунодефицитов. Препарат оказывает регулирующее влияние на реакции клеточного и гуморального звеньев иммунитета и неспецифическую резистентность организма, усиливает функциональную активность ПМЯЛ и макрофагов, стимулирует образование, дифференцировку и функциональную активность Т-лимфоцитов, синтез специфических антител в сыворотке крови, уменьшает развитие аутоиммунных процессов, обладает антигистамин-ными, антисеротониновыми, противовоспалительными свойствами.
Ганглин зарегистрирован в качестве пищевой добавки для ветеринарии, корригирующей иммунодефициты и оказывающей положительное влияние на гомопоэз.
Препарат гидробионтов - молокин - получен из молок лососевых рыб; наряду с иммунорегулирующей активностью обладает гонадо-тропными свойствами.
Препарат вермин (НПО «Биомед») представляет собой очищенную, стерильную, лиофильно высушенную смесь белков и пептидов, экстрагированных из гомогената червей Eisenia foetida; препарат нетоксичен, не проявляет мутагенной активности; обладает ферментативной активностью оксидоредуктаз, трансфераз и гидролаз, оказывает иммуномо-дулирующее действие. Мазь на основе вермина предложена для лечения длительно незаживающих гнойных ран.
Дата добавления: 2016-07-22; просмотров: 2493;











