СРЕДСТВА СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ, ТЕРАПИИ И ДИАГНОСТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 3 глава
Для изучения подвижности культуру засевают уколом в полужидкий агар (0,2 %), посевы культивируют при 20...22 "С. Сначала возбудитель растет по уколу, затем рост распространяется по всему столбику питательной среды (подвижен). У выделенных культур бактерий изучают морфологические и тинкториальные свойства клеток, ферментативную активность.
Листерии разлагают с образованием кислоты без газа глюкозу, мальтозу, рамнозу, салицин, трегалозу, выделяют каталазу, обесцвечивают при росте в МПБ ряд красителей (индикаторные среды с метиленовым синим, нейтральротом, метилротом, конгоротом, амидо черным в концентрации 0,001...0,003 %). Пробирки с индикаторными средами засевают исследуемой культурой, помещают в термостат при 37 °С и учитывают результат через 3, 6, 24 и 48 ч. Помимо L. monocytogenes могут быть выделены другие виды листерий (L. denitrificans редуцирует нитраты, разлагает сахарозу и арабинозу; L. iwanonii постоянно ферментирует лактозу, не утилизирует рамнозу, образует двойную или тройную зону гемолиза на кровяном агаре. Оба вида листерий патогенны для мышей).
Для дифференциации листерий от возбудителя рожи свиней используют следующие критерии (табл. 19).

По 14 соматическим и 5 жгутиковым антигенам листерии подразделяют на 16 основных серотипов (сероваров). По данным отечественных авторов, наиболее часто удается изолировать штаммы Первого серотипа.
Для видовой идентификации на предметное стекло наносят каплю поливалентной агглютинирующей сыворотки, в нее вносят суспензию 24-часовой агаровой культуры с концентрацией клеток 1*1010/мл. Результат учитывают через 3 мин. Поливалентная сыворотка агглютинирует все антигенные варианты возбудителя, контролем служит суспензия бактерий в капле физиологического раствора. На втором этапе при помощи серотиповых сывороток определяют серотип выделенного возбудителя.
Биопроба. Метод применяют для обнаружения возбудителя в исследуемом материале и изучения патогенных свойств бактерий. В первом случае тканевой суспензией заражают двух-трех белых мышей подкожно или внутрибрюшинно по 0,3...0,5 мл. В положительном случае мыши погибают через 2...6 сут, особенно чувствительны 5...6-дневные мышата, которые гибнут через 18...36 ч. Павших животных подвергают бактериологическому исследованию.
Конъюнктивальную пробу ставят для дифференциации выделенной культуры от возбудителя рожи свиней. На конъюнктиву глаза морской свинки наносят две капли бульонной культуры изучаемой бактерии. Вирулентные листерии на 2...4 сут вызывают гнойный кератоконъюнктивит.
Серологическая диагностика: серологические методы применяют в хозяйстве, где уже поставлен диагноз на листериоз, для выяснения эпизоотической ситуации. Используют пробирочную РА и РСК. Диагностический титр РА для крупного рогатого скота и лошадей 1:400 (1:200 — сомнительный), для овец, коз и свиней — 1:200 (1:100 — сомнительный), для кроликов — 1:50 (1:25 — сомнительный). В РСК исследуют сыворотки крови, разведенные 1:10.
Биопрепараты. Сухая живая вакцина против листериоза сельскохозяйственных животных из штамма АУФ представляет собой культуру лиофильно высушенного аттенуированного штамма листерии Первого серотипа. Вакцину контролируют на чистоту роста, безвредность и иммуногенность (на кроликах).
Листериозные диагностические агглютинирующие сыворотки. Листериозные флуоресцирующие сыворотки. Разработана вакцина из двух серотипов листерии.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Приготовить мазки из культур вакцинных штаммов листерии и возбудителя рожи свиней, окрасить по Граму, промикроскопировать, зарисовать.
2. Изучить культуральные и ферментативные свойства листерии и возбудителя рожи свиней.
3. Ознакомиться с биопрепаратами для специфической профилактики и диагностики листериоза и рожи свиней.
Контрольные вопросы
1. Каковы морфологические, культуральные, ферментативные и патогенные
свойства возбудителей рожи свиней, листериоза?
2. В чем состоит лабораторная диагностика рожи свиней и листериоза?
3. Какова антигенная структура возбудителей рожи свиней, листериоза и какие
методы применяют для их серологической идентификации?
4. Какие методы используют для серологической диагностики листериоза?
5. Какие биопрепараты разработаны для специфической профилактики и диагностики листериоза и рожи свиней?
Тема 24
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА, ПАРАТУБЕРКУЛЕЗА, АКТИНОМИКОЗА. БИОПРЕПАРАТЫ
Цель занятия. Ознакомить студентов со свойствами возбудителей, методами лабораторной диагностики туберкулеза и парату-беркулеза, актиномикоза, биопрепаратами.
Оборудование и материалы. Суспензия микобактерий в смеси со стафилококками, эшерихиями (вакцина БЦЖ), культуры микобактерий на среде Петраньяни (Левенштейна—Иенсена), красители для окраски по методу Циля—Нильсена, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Туберкулез. Это хроническое инфекционное заболевание домашних и диких животных, в том числе птиц, а также человека. Характеризуется образованием туберкулов (бугорков) в различных органах и тканях. Наиболее восприимчивы к туберкулезу крупный рогатый скот, свиньи и куры.
Возбудителя туберкулеза относят к роду Mycobacterium, семейству Mycobacteriaceae. Наибольшее значение в патологии сельскохозяйственных животных (и человека) имеют следующие виды: М. tuberculosis — возбудитель туберкулеза человека, М. bovis — возбудитель туберкулеза крупного рогатого скота, М. avium — возбудитель туберкулеза птиц.
Лабораторная диагностика туберкулеза основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале (методом световой и люминесцентной микроскопии и биопробой), выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим, ферментативным и патогенным признакам.
Материал для исследования. От павших или убитых с диагностической целью сельскохозяйственных животных берут лимфатические узлы — заглоточные, подчелюстные, бронхиальные, средостенные, брыжеечные, печеночные, надвымянные, а также кусочки печени, легких и селезенки. Тушки птиц направляют в лабораторию целиком — исследуют пораженные печень, легкие, селезенку, яичники. От живых животных берут пробы молока и спермы. При взятии патологического материала необходимо соблюдать правила личной безопасности.
Материал доставляют в лабораторию свежим, в замороженном виде или консервируют 30...40%-м водным раствором глицерина. Обсемененность патологического материала микобактериями туберкулеза может быть незначительной, поэтому для получения достоверных диагностических результатов специальными методами обработки повышают концентрацию возбудителя. К обработке предъявляют ряд требований: она должна обеспечивать гомогенизацию материала, уничтожать сопутствующую микрофлору, быть щадящей для микобактерий туберкулеза и способствовать их концентрации в материале (обогащение).
Кусочки органов и тканей измельчают, заливают 3...10%-м раствором серной кислоты в соотношении 1 : 4, пробу центрифугируют при 3000 мин-1 10... 15 мин. Осадок суспендируют в небольшом количестве физиологического раствора и используют для посевов и приготовления мазков для микроскопии (перед посевом осадок можно дополнительно отмыть физиологическим раствором два-три раза путем центрифугирования).
Пробу молока (150 мл) центрифугируют при 3000 мин-1 20...30 мин. Осадок обрабатывают 3...6%-м раствором серной кислоты 20…30 мин, тщательно взбалтывают и центрифугируют. Осадок высевают на питательные среды.
Яйца перед исследованием инкубируют в термостате при 37...38 °С 20 дней, после чего содержимое измельчают, обрабатывают 3... 10%-м раствором серной кислоты, центрифугируют и осадок используют для посевов и микроскопии.
Для концентрирования микобактерий в исследуемом материале применяют метод флотации. Материал гомогенизируют с физиологическим раствором до консистенции сметаны и 10 мл гомогената вносят в колбу с узким горлом на 250 мл, добавляют 10 мл 1%-го раствора гидроксида натрия. Колбу закрывают и смесь встряхивают в течение 10 мин. Затем смесь разбавляют дистиллированной водой в соотношении 1:9 и прибавляют 1...2мл ксилола (петролейного эфира или авиационного бензина), смесь вновь встряхивают в течение 5... 10 мин, добавляют дистиллированную воду (до горлышка колбы) и оставляют при комнатной температуре на 30 мин. Микотуберкулезные бактерии концентрируются во флотационном кольце у горлышка колбы вместе с каплями ксилола, которые, всплывая на поверхность, увлекают за собой и микобактерий. Содержимое образовавшегося кольца используют для посевов и приготовления мазков для микроскопии, нанося материал на стекло несколько раз по мере подсыхания.
Микроскопия препаратов из исходного материала. Микобактерий — прямые или слегка изогнутые палочковидные клетки размером (0,2...0,6) х (1...10) мкм, без спор, капсул и жгутиков; грам-положительные, кислото- и спиртоустойчивые. Кислотоустойчивость связана с присутствием в клеточной стенке липидов и ми-коловой кислоты (до 60 %). В цитоплазме располагаются кислотолабильные гранулы, состоящие в основном из метафосфата (зерна Муха). Дилиды и воскоподобные вещества придают микробной клетке гидрофобность, т. е. способность отталкивать воду и водные растворы красителей, кислот, щелочей, в связи с чем бактерии туберкулеза (и паратуберкулеза) плохо воспринимают окраску. Для окрашивания микобактерий применяют специальные методы, среди которых самый распространенный — метод Циля—Нильсена. По Цилю—Нильсену микобактерий окрашиваются в ярко-красный цвет.
В препаратах М. tuberculosis обнаруживают в виде тонких прямых (изогнутых) палочек, М. bovis представляет собой короткие и толстые палочки, М. avium мельче остальных видов, со склонностью к полиморфизму (рис. 78).
| Рис. 78. Микобактерий в окрашенном препарате из мокроты: / — микобактерий; 2 — тканевые элементы |

Бактериоскопический метод отличает невысокая чувствительность: с его помощью возбудитель выявляют при концентрации микобатерий (1...5)105/мл. Более результативна люминесцентная микроскопия (окраска аурамин-родамином), благодаря которой выявляют даже незначительное количество микобактерий, которые окрашены в бело-желтый цвет, а также формы с измененными тинкториальными свойствами.
Выделение и идентификация культуры возбудителя. Микобакте-
рии — аэробы, температурный оптимум 37...38 °С, рН 6,4...7. Растут медленно. Для культивирования микобактерий туберкулеза
используют сложные питательные среды, содержащие глицерин,
картофель, яйца, витамины. Рост бактерий стимулируют аспарагиновая кислота, альбумин, глюкоза, биотин, никотиновая кислота, соли аммония и др. Наиболее часто применяют среды Петраньяни, Левенштейна—Иенсена, Гельберга.
Рост микобактерий бычьего вида на плотных средах чаще обнаруживают на 20...60-е сутки, человеческого вида — на 14...40-е сутки, птичьего — на 10...20-е сутки (рис. 79).

| Рис. 79. 1,5-месячный рост микобактерий туберкулеза птичьего типа на среде Петраньяни (штаммные № 6, 15, ЗП, 25) |
М. bovis на плотных питательных средах формирует мелкие гладкие шаровидные колонии цвета слоновой кости, иногда с морщинистым сероватым налетом. На жидких средах образует пленку на поверхности сначала в виде единичных островков, позднее — сливающихся в сплошную пленку.
М. tuberculosis на плотных питательных средах дает рост в виде сухого морщинистого налета кремового цвета. У колоний приподнятый центр, они крошковидные, с приятным запахом, по виду напоминают цветную капусту, плохо смачиваются водой. На жидких средах рост наблюдают на 5...7-е сутки в виде сухой морщинистой пленки, поднимающейся на края пробирок, среда остается прозрачной. На жидких средах и при внутриклеточном развитии образуется корд-фактор (трегалоза-6,6-дипиколат), способствующий сближению бактериальных клеток в микроколониях и их расположению в виде серпантинообразных кос, что можно наблюдать при микроскопическом исследовании (рис. 80). В средах, содержащих детергент (твин-80), вследствие потери клетками гидрофобности наблюдают диффузный рост.
Рис. 80. Серпантинообразное расположение клеток микобактерий в микрокультуре (корд-фактор)

М. avium на плотных яичных средах растет в виде гладкого маслянистого налета. Колонии округлые, слизистые, мягкие, серовато-белые, с возрастом желтеют, иногда образуют возвышение в виде пуговицы с кратерообразным углублением. При первичной изоляции из патологического материала колонии плоские и полупрозрачные. В жидких питательных средах возбудитель дает диффузный рост с формированием
влажной жирной пленки и образованием рыхлого осадка. Биохимические свойства микобактерий указаны в таблице 20.
Биопроба. Метод применяют не только для обнаружения возбудителя в исследуемом материале, но и для определения его видовой принадлежности. Биопробу ставят параллельно с культу-ральными исследованиями.
Для определения вида заражают двух морских свинок, двух кроликов, при необходимости и двух кур. Перед постановкой биопробы морским свинкам и курам проводят туберкулинизацию. В опыт берут животных, не реагирующих на введение туберкулина. Для заражения используют культуру или исследуемый материал, обработанный серной кислотой (см. «Материал для исследования»). Морским свинкам суспензию материала вводят по 1...2 мл подкожно в паховую область, кроликам — внутривенно, курам — в подкрыльцовую вену. За подопытными животными ведут наблюдение, в течение трех месяцев. У морских свинок в положительных случаях через 2...3 нед в месте введения образуется уплотнение, потом язва, увеличиваются регионарные лимфоузлы. Через 30 сут после заражения свинкам повторяют ту-беркулинизацию. При наличии клинических признаков заболевания и положительной реакции на туберкулин одну морскую свинку подвергают убою с последующим патологоанатомическим исследованием и приготовлением из пораженных органов мазков, которые окрашивают по методу Циля—Нильсена. При обнаружении в мазках микобактерий туберкулеза дают положительное заключение на туберкулез и биологическое исследование прекращают.
Возбудитель относят к тому или иному виду микобактерий, основываясь на следующих результатах биопробы (табл. 21).

Серологическая диагностика: постановку РСК рекомендуют как дополнительный метод при отборе для диагностического убоя животных, положительно реагирующих на туберкулин.
Аллергическая диагностика. Не принадлежит к лабораторным методам, но на практике имеет ведущее значение для прижизненного определения инфекции у животных, в том числе у птиц.
Применяют сухой очищенный туберкулин (протеин—пурифиед—дериват: ППД), который вводят крупному рогатому скоту, буйволам, верблюдам, оленям в толщу кожи в области средней трети шеи, свиньям — на наружную поверхность основания уха, курам — в толщу кожи бородки. Реакцию учитывают через 72 ч, измеряя толщину кожной складки с учетом припухлости. Положительной реакцией считают тестоватый отек кожи размерами 35 х 45 мм и более, который на ощупь теплее окружающих тканей. Кожная складка увеличивается на 3 мм и более. Для измерения кожной складки используют кутиметр. У кур реакцию учитывают через 30...36 ч: при положительной реакции бородка опухает, становится горячей и отвисает.
Биопрепараты. Вакцина БЦЖ (BCG) представляет собой живую лиофильно высушенную культуру вакцинного штамма туберкулезных микобактерий бычьего типа. Вакцинный штамм BCG (Bacillus Calmette — Gueriri) был получен в 1924 г. французскими учеными Кальметтом и Гереном путем длительного культивирования (в течение 18 лет) вирулентного штамма М. bovis на картофельно-глицериновой среде с добавлением бычьей желчи. Для приготовления противотуберкулезной вакцины штамм БЦЖ выращивают на специальных средах в течение 20 дней. Приготовленную вакцину высушивают методом лиофилизации и применяют для профилактики туберкулеза у людей (прививают всех новорожденных). В ветеринарной практике вакцину БЦЖ используют в неблагополучных по туберкулезу хозяйствах для профилактики туберкулеза у крупного рогатого скота.
Сухой очищенный туберкулин ППД для млекопитающих готовят из культуры микобактерий, которую выращивают в течение двух месяцев, а затем стерилизуют автоклавированием. Белок из культуральной жидкости осаждают трихлоруксусной кислотой. Преципитат белка, отделенный центрифугированием, растворяют в воде и вновь осаждают сульфатом аммония. Белок — это основная фракция туберкулина ППД, содержание белка составляет 73,4...90 %. Кроме того, в состав препарата входят полисахариды, липиды, нуклеиновые кислоты.
Альттуберкулин (АТК) для млекопитающих — это стерильный фильтрат культуры микобактерий, выращенных в течение двух месяцев на мясо-гидролизатном картофельно-глицериновом бульоне. Бульон концентрируют, выпаривая до 1/10 первоначального объема, и затем добавляют 20 % экстракта бактериальной массы микобактерий.
ППД-туберкулин для птиц готовят, используя пять штаммов М. avium. Выделение белка из культуральной жидкости и приготовление препарата проводят, как при получении АТК.
Сухой очищенный комплексный аллерген из атипичных микобактерий (КАМ) готовят во ВГНКИ по типу ППД-туберкули-на. Симультанную пробу КАМ используют в качестве дополнительного метода диагностики в благополучных по туберкулезу хозяйствах. Туберкулины контролируют на стерильность, безвредность, специфичность и активность.
Паратуберкулез (паратуберкулезный энтерит). Хроническая болезнь крупного рогатого скота, реже овец. Характеризуется нарушением деятельности желудочно-кишечного тракта, приводящим к истощению и гибели животного
Возбудитель паратуберкулеза — М. paratuberculosis, род Mycobacterium, семейство Mycobacteriaceae.
Лабораторная диагностика паратуберкулеза основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой и люминесцентной микроскопии (микроскопия — это основной метод), выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культу-рально-морфологическим признакам.
Материал для исследования. От павших или убитых с диагностической целью животных берут пораженные участки подвздошной кишки — утолщенные, с выраженной складчатостью слизистой оболочки и брыжеечные лимфоузлы. От живых животных в лабораторию направляют фекалии с примесью слизи и крови и соскобы со слизистой оболочки прямой кишки.
Микроскопия препаратов из исходного материала. В мазках, окрашенных по методу Циля—Нильсена, возбудители паратуберку-леза темно-красного цвета, палочковидной формы, размером (0,6...2) х (0,2...0,5) мкм. Для старых культур характерен полиморфизм: палочки могут быть расширенными или в виде глыбок, кокков. В мазках из патологического материала клетки располагаются кучками в виде «палисада» (частокола). Возбудитель неподвижен, не образует спор и капсул, кислотоустойчив.
Кроме световой применяют также люминесцентную микроскопию мазков-отпечатков из патологического материала, окрашенных флуорохромами, как при туберкулезе.
Выделение и идентификация культуры возбудителя. Культивирование и выделение чистой культуры возбудителя сопряжены с большими трудностями. В питательные среды добавляют (до 1...4%) ростовой фактор микобактин — спиртовой экстракт из микобактерий флей (тимофеевой травы) или же экстракт из микобактерий других видов. По типу дыхания возбудитель — аэроб, температурный оптимум 38 °С.
В жидких питательных средах образует нежную беловатую пленку, которая через З...4мес опускается на дно пробирки. На плотных питательных средах через 1,5...2мес вырастают сухие сморщенные беловато-серые или желтоватые колонии.
Биопроба. При паратуберкулезе этот метод не применяют, так как лабораторные животные к возбудителю невосприимчивы.
Серологическая диагностика основана на исследовании в РСК: реакцию ставят с пробами сывороток крови от больных животных по общепринятой методике.
Аллергическая диагностика. Метод, применяемый в хозяйствах. Для аллергической диагностики паратуберкулеза у крупного рогатого скота используют альттуберкулин для птиц, стандартный сухой очищенный туберкулин ППД для птиц и паратуберкулин, у овец — сухой очищенный туберкулин ППД для птиц.
Актиномикоз. Хроническая бактериальная инфекция; характеризуется образованием в различных тканях плотных, четко ограниченных припухлостей — актиномиком, подверженных некротическому распаду (рис. 81). Восприимчивы различные виды животных и человек. Возбудитель — бактерия из группы актиномицет — Actinomyces bovis. У человека актиномикоз вызывает A. Israeli.
Лабораторная диагностика актиномикоза основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и ферментативным свойствам.
Материал для исследования. В лабораторию направляют пораженные лимфатические узлы, стерильно взятый гной из абсцессов.
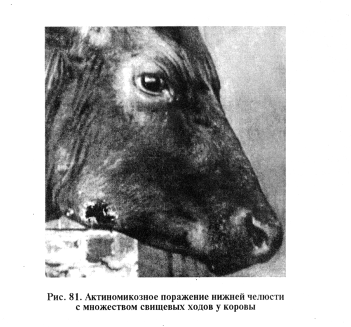
Микроскопия препаратов из исходного материала. Для приготовления препаратов в материале находят твердые серовато-белые зернышки с зеленоватым оттенком — друзы, которые представляют собой скопление клеток возбудителя. Их промывают в дистиллированной воде и переносят на предметное стекло в каплю 10...20%-го раствора гидроксида натрия или калия, выдерживают 15 мин или слегка подогревают над пламенем горелки. Окрашивают по Граму. Затем наносят каплю 50%-го водного раствора глицерина, накрывают препарат покровным стеклом и исследуют под малым увеличением микроскопа или с помощью иммерсионной системы. При микроскопировании заметен гомогенный центр друзы, состоящий из густо переплетенных нитевидных палочек, булавовидно утолщающихся к периферии (рис. 82). Центр друзы окрашен грамположительно, а периферическая часть — грамотрицательно. Такая микроскопическая картина характерна и имеет диагностическое значение. Друзы в экссудате могут быть не всегда, несмотря на наличие отдельных клеток.
Выделение и идентификация культуры возбудителя. Возбудитель — факультативный анаэроб, температурный оптимум 37...38 ºС. Материал высевают на МПА, содержащий 1 % глюкозы, ПЖА с 1 % глюкозы, кровяной или сывороточный агар.
Макроскопически видимые колонии появляются через 7…14 дней, иногда 15...30 дней культивирования. Колонии на МПА с глюкозой первоначально белые, мягкой консистенции, с ровными краями, иногда с клиновидными выступами по периферии. Со временем колонии приобретают светло-коричневую окраску. При выращивании в анаэробных условиях формируются гладкие, выпуклые, непрозрачные, влажные колонии, на кровяном МПА вокруг колоний образуется слабая зона гемолиза. В мазках из культур, выращенных в аэробных условиях, обнаруживают нити и цепочки из грамположительных палочек, в анаэробных — короткие палочки.
У выделенных культур изучают ферментативную активность: возбудитель разжижает желатину, ферментирует с образованием кислоты глюкозу, левулезу, галактозу, глицерин.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Приготовить мазки из смеси бактерий, окрасить по методу Циля—Нильсена, промикроскопировать, зарисовать.
2. Описать характер роста микобактерий на питательных средах.
4. Ознакомиться с биопрепаратами.
Контрольные вопросы
1.Какова таксономическая характеристика возбудителей туберкулеза и паратуберкулеза?
2.Каковы морфологические и тинкториальные особенности возбудителей туберкулеза и паратуберкулеза?
3.В чем состоят культуральные особенности возбудителей туберкулеза и паратуберкулеза?
4.По каким свойствам дифференцируют возбудителей туберкулеза и паратуберкулеза?
5.В чем заключается лабораторная диагностика актиномикоза?
Тема 25
ЛАБОРАТОРНАЯ ДИАГНОСТИКА СИБИРСКОЙ ЯЗВЫ. БИОПРЕПАРАТЫ
Цель занятия. Ознакомить студентов со свойствами возбудителя, схемой лабораторной диагностики сибирской язвы, биопрепаратами.
Оборудование и материалы. Культура вакцинного штамма В. anthracis на МПА, в МПБ, мазки с феноменом «ожерелья», сибиреязвенная преципитирующая сыворотка, стандартный антиген, пробирки Уленгута, штативы, пипетки Пастера, сибиреязвенные биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Сибирская язва. Острое инфекционное заболевание сельскохозяйственных животных многих видов, а также человека; характеризуется признаками септицемии или образованием карбункулов, у свиней часто протекает с поражением заглоточных лимфатических узлов.
Возбудитель сибирской язвы — бактерия Bacillus anthracis, род Bacillus.
Лабораторная диагностика сибирской язвы основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале (методом световой и люминесцентной микроскопии, а также биопробой), выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим признакам. При нечетких результатах применяют и другие методы.
Материал для исследования. В лабораторию направляют ухо от трупа животного, перевязанное у основания (ухо отрезают с той стороны, на которой лежит труп), или кровь из надреза уха в виде толстого мазка на двух предметных стеклах (чтобы исключить попадание возбудителя во внешнюю среду, место разреза прижигают шпателем); от трупов свиней -заглоточные лимфатические узлы и участки отечной соединительной ткани. Если подозрение на сибирскую язву возникло в ходе вскрытия, его прекращают и на исследование направляют часть селезенки.
Нативный материал помещают в чистую посуду (пробирки, банки). Высушенные мазки кладут в чашки Петри, которые оборачивают плотной бумагой. На упаковке делают надпись «Мазок не фиксирован!» Посуду с материалом помещают во влагонепроницаемую тару, обвязывают, пломбируют или опечатывают, делают надпись «Верх. Осторожно!» и с сопроводительными документами нарочным направляют в лабораторию.
Микроскопия препаратов из исходного материала. Возбудитель представляет собой грамположительные прямые палочковидные бактерии размером (l...l,5) х (6...10) мкм, без жгутиков, образует спору и капсулу.
Из поступившего в лабораторию материала готовят мазки, окрашивают по Граму; одним из методов для выявления капсулы (методы Михина, Гимзы, Ольта и т. д.), а также сибиреязвенными люминесцирующими сыворотками. В окрашенных мазках из трупного материала возбудитель обнаруживают в виде крупных грамположительных палочковидных бактерий, располагающихся одиночно, парами, короткими цепочками. Концы палочек, обращенные друг к другу, резко обрублены,.свободные концы закруглены, клетки окружены капсулой. В отдельных случаях, особенно в мазках из материала, полученного от свиней, форма клеток может быть нетипичной: короткие, толстые, изогнутые или зернистые палочки со вздутием в центре или на концевых частях бактерий.
Предварительный ответ в хозяйство, откуда поступил материал, ддют немедленно по результатам микроскопического исследования.
Выделение и идентификация культуры возбудителя. Факультативный анаэроб, температурный оптимум 35...37 °С, рН 7,2...7,4. С целью выделения культуры возбудителя исследуемый материал засевают в МПБ, на МПА или в бульон и агар Хоттингера и инкубируют в аэробных условиях 18...24 ч, а при отсутствии роста — до 48 ч.
На МПА М. anthracis формирует плоские, матово-серые, шероховатые, с отростками на краях колонии (R-форма), может образовывать и атипичные колонии без отростков. Края колоний R-формы под малым увеличением микроскопа имеют вид локонов, получивших название «львиная грива» (рис. 83). В МПБ рост возбудителя характеризуется образованием на дне пробирки рыхлого осадка при прозрачной питательной среде; после встряхивания осадок разбивается на хлопья. Если возбудитель выращивать на питательных средах, содержащих сыворотку крови, и в атмосфере с повышенным содержанием оксида углерода (IV), то на МПА образуются гладкие колонии S-формы, а в МПБ отмечают рост в виде диффузного помутнения среды.

Рис. 83. Колонии В. anthracis на агаре под малым увеличением. Образование локонов
Дата добавления: 2016-07-22; просмотров: 2691;











