Принцип действия АБ
Принцип действия аккумуляторов основан на поляризации свинцовых электродов. Под действием постоянного тока зарядного агрегата электролит (раствор серной кислоты) разлагается на кислород и водород. Продукты разложения вступают в химическую реакцию со свинцовыми электродами: на положительном электроде, т. е. на электроде, присоединенном к плюсу зарядного агрегата, образуется двуокись свинца (Рb02), а на отрицательном электроде, присоединенном к минусу зарядного агрегата — губчатый свинец.
В результате образуется гальванический элемент с напряжением около 2 В. Анодом в нем является двуокись свинца, а катодом — губчатый свинец. При разряде такого элемента в нем произойдет обратный химический процесс: химическая энергия превращается в электрическую. Под влиянием разрядного тока из электролита выделяются кислород и водород.
Поскольку разрядный ток внутри аккумулятора идет в направлении, обратном направлению тока заряда, кислород будет выделяться на отрицательном электроде, водород — на положительном.
Кислород и водород, вступая в реакцию с двуокисью свинца и губчатым свинцом, восстанавливают первую и окисляют второй. По достижении равновесного состояния разряд прекращается. Такой элемент обратимый и может быть повторно заряжен.
С момента создания свинцово-кислотного аккумулятора (1869 г. Офицер российского ВМФ лейтенант Тверитинов) было предложено много теорий, объясняющих процессы его заряда и разряда. Однако лишь одна теория, «теория двойной сульфатации» (Гладстон и Трайб, 1882 г.), несмотря на выдвигавшиеся против нее возражения, является общепринятой. Теория «двойной сульфатации» означает, что при разряде аккумулятора активная масса обоих электродов превращается в сульфат свинца (сернокислый свинец). Основные положения этой теории состоят в следующем.
Процесс разряда
В заряженном аккумуляторе положительный электрод (анод) состоит из двуокиси свинца (РbО2), отрицательный—из губчатого свинца (РЬ), Электролит— раствор серной кислоты с удельным весом от 1,18 до 1,32 в зависимости от типа аккумулятора.
При включении аккумулятора на разряд ток внутри аккумулятора протекает от катода к аноду, при этом серная кислота частично разлагается, и на положительном электроде выделяется водород. Совершается химическая реакция, при которой двуокись свинца превращается в сульфат свинца (PbSO4) и выделяется вода. Остаток SO4 частично разложившейся серной кислоты вступает в соединение с губчатым свинцом катода, также образуя сульфат свинца.
Таким образом, во время разряда активная масса обоих электродов превращается в сульфат свинца. На эту реакцию расходуется серная кислота, и образуется вода. Благодаря этому удельный вес электролита по мере разряда снижается.
Химические реакции, происходящие в аккумуляторе во время разряда, приближенно описываются уравнениями:
Электролиз электролита:
H2SO4=H2+ SO4.
Реакция у положительного электрода:
РЬО2 + Н2 + H2SO4 = 2Н2О + PbSO4.
Реакция у отрицательного электрода:
Pb + SO4 = PbSO4.
Общее уравнение разряда:
РЬО2 + РЬ + 2Н2 SO4 = 2PbSO4 + 2Н2О.
Процесс заряда
В разряженном аккумуляторе оба электрода состоят в основном из сульфата свинца PbSO4. Электролит — раствор серной кислоты со сниженным удельным весом. Постоянный ток от зарядного агрегата проходит от положительного электрода через электролит к отрицательному электроду. Электролит частично разлагается на водород Н2 и радикал SO4. Водород переносится к отрицательному электроду, восстанавливает на нем сульфат свинца до губчатого свинца и образует серную кислоту. На положительном электроде происходит сложная реакция. Две части воды, образовавшиеся при разряде, отдают свой водород Н2 на образование двух частей серной кислоты из радикала SO4, выделяющегося на положительном электроде, и радикала SO4 сульфата свинца положительного электрода. Кислород О2 двух частей воды, потерявших водород, соединяется со свинцом сульфата свинца положительного электрода, образуя двуокись свинца РЬО2. К концу заряда сульфат свинца на отрицательном электроде восстанавливается до губчатого свинца, а на положительном электроде превращается в двуокись свинца. При этом образуется серная кислота и расходуется вода. Удельный вес электролита повышается.
Химические реакции, происходящие в аккумуляторе при заряде, приближенно описываются уравнениями:
Электролиз серной кислоты:
H2SO4 = Н2 + SO4
Реакция у положительного электрода:
PbSO4 + 2Н2О + SO4 = РЪО2 + 2H2SO4.
Реакция у отрицательного электрода:
PbSO4+ Н2 = РЬ + H2SO4.
Общее уравнение заряда:
2PbSO4. + 2Н2О = РЬО2 + Pb + 2H2SO4.
Сравнивая общие уравнения разряда и заряда, можно установить, что они тождественны, но идут в разных направлениях. Это тождество можно изобразить следующим уравнением:
| |
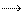 РЬО2 + Pb + 2H2SO4 2PbSO4+ 2H2O.
РЬО2 + Pb + 2H2SO4 2PbSO4+ 2H2O.

Знак → соответствует реакции разряда, а знак ← реакции заряда.
|
На рисунке 38.10 показана иллюстрация химических реакций во время заряда и разряда АБ.
Батареи типа СК
Устройство АБ
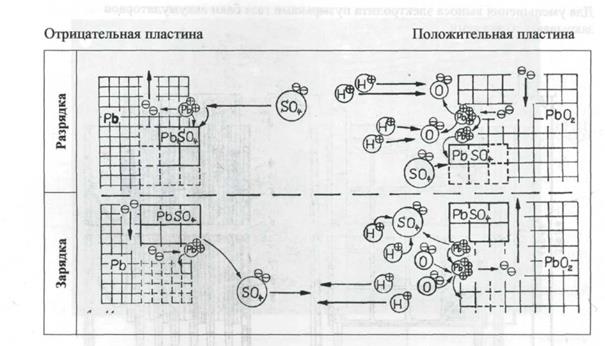
АБ набираются путем последовательного соединения аккумуляторов. Аккумулятор состоит из блока положительных и отрицательных электродов, помещенных в стеклянный бак. Разрез АБ типа СК показан на рисунке 38.11., а общий вид на рисунке 38.12.
В стеклянных баках электроды подвешиваются ушками на верхние кромки бака. Ушки электродов привариваются к соединительным полосам, с помощью которых аккумуляторы соединяются в батарею. Для изоляции электродов друг от друга применяются сепараторы из мипласта.
В качестве электролита применяется раствор серной кислоты плотностью 1,18 г\см3 (при температуре +20°С).
Для уменьшения выноса электролита пузырьками газа баки аккумуляторов закрываются стеклами.
|
 |

|
Режимы работы АБ
АБ эксплуатируются в режиме постоянного подзаряда. Напряжение
подзаряда должно составлять 2,2 ± 0,05 В на аккумулятор для компенсации саморазряда и поддержания батарей в полностью заряженном состоянии.
Дополнительные (хвостовые) элементы, как и основная батарея. должны поддерживаться в режиме постоянного подзаряда.
Напряжение на батарее, содержащейся в состоянии постоянного подзаряда, должно поддерживаться стабильным автоматически. Точность стабилизации должна быть в пределах ±2%.
Дата добавления: 2020-10-14; просмотров: 898;











