Внутриклеточные этапы созревания коллагена
Синтез и созревание (процессинг) коллагена
Коллаген синтезируется внутри различных клеток соединительной ткани (фибробластов, хондробластов, остеобластов, одонтобластов и др.) на прикрепленных к мембранам эндоплазматического ретикулума (ЭПР) рибосомах в виде препроколлагена, содержащего на N-конце сигнальную последовательность, состоящую приблизительно из 100 аминокислотных остатков.
После синтеза полипептидной цепи следует многоэтапный процесс созревания коллагена, так называемый процессинг, происходящий как внутри, так и вне клеток.
Внутриклеточные этапы созревания коллагена
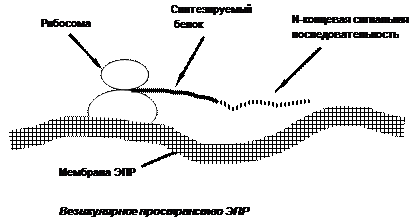
А.Проникновение в эндоплазматический ретикулум сигнальной последовательности и ее отщепление
После проникновения сигнальной последовательности аминокислот в везикулярное пространство эндоплазматического ретикулума, происходит ее отщепление под действием специфической протеиназы, а укороченная молекула синтезируемого белка, которая получает название проколлагена, продолжает продвижение в везикулярное пространство эндоплазматического ретикулума.
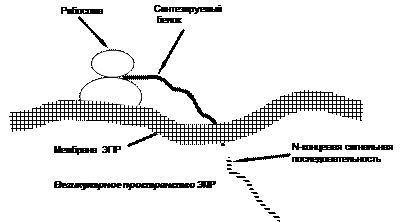
Б.Гидроксилирование аминокислотных остатков лизина и пролинаначинается уже в период синтеза белковой молекулы на рибосоме и катализируется монооксигеназами (гидроксилазами), связанными с мембранами эндоплазматической сети.
Аминокислотные остатки пролина подвергаются действию пролил-3-гидроксилазы и пролил-4-гидроксилазы, которые гидроксилируют метиленовые группы, соответственно, в третьем и четвертом положении в кольце. В аминокислотные остатки лизина гидрокси-группа вводится в пятое положение в результате действия лизил-5-гидроксилазы.
Источником атома кислорода в реакции гидроксилирования является молекула кислорода, причем один атом кислорода включается в состав гидрокси-группы аминокислотного остатка, а второй атом - в сукцинат, образующийся при окислительном декарбоксилировании α-кетоглутарата. Гидроксилазы содержат в активном центре атом железа в степени окисления +2. Чтобы избежать окисления железа необходимо наличие восстановителя, в роли которого выступает аскорбиновая кислота. Окисляясь, она трансформируется в дегидроаскорбиновую кислоту. Для регенерации аскорбиновой кислоты в исходное состояние в тканях организма имеется специфическая ферментативная реакция, в которой участвует восстановленный глутатион (на схеме не показан):
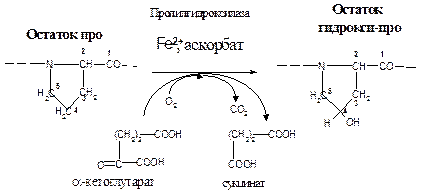
Гидроксилирование пролина имеет важное значение для поддержания структуры тройной спирали коллагена, поскольку гидрокси-группы участвуют в образовании водородных связей. В свою очередь, гидроксилирование лизина также играет существенную биологическую роль, поскольку синтезированный гидроксилизин является участником последующего гликозилирования проколлагена. Кроме того, аминокислотные остатки гидроксилизина, как и аминокислотные остатки лизина, участвуют в реакции окислительного дезаминирования по e-аминогруппам и превращаются в гидроксиаллизин (см. ниже), который непосредственно участвует в образовании ковалентных связей между молекулами белка после сборки волокон незрелого коллагена.
Недостаток витамина С приводит к нарушению гидроксилирования остатков пролина и лизина. Поскольку, как и все другие белки организма, коллаген постоянно обновляется, следствием недостатка витамина С является дефектный процессинг коллагена, приводящий к синтезу менее прочных и менее стабильных коллагеновых волокон. Так как коллаген играет важную роль в формировании всех типов соединительной ткани, при С-авитаминозе в организме проявляются различные морфологические и структурные нарушения: хрупкость и ломкость кровеносных сосудов, нарушения белкового состава межклеточного матрикса минерализованных тканей, непрочность тканей пародонта. Клинической картиной сильно развитого гиповитаминоза С является цинга, которая сопровождается множественными точечными кровоизлияниями под кожу и слизистые оболочки, кровоточивостью десен и стенок кишечника, множественным кариесом, выпадением зубов, анемией. У детей с недостатком витамина С связано замедление роста костной ткани, а также зубов.
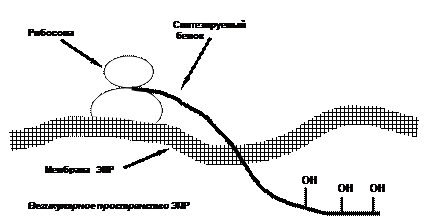
В. Ферментативное гликозилирование аминокислотных остатков гидроксилизина протекает под действием гликозилтрансфераз вплоть до формирования тройной спирали из трех цепей проколлагена.Углеводные остатки связываются с 5-ОН-группами гидроксилизина О-гликозидными связями. Чаще всего углеводными компонентами являются глюкоза или дисахарид галактозилглюкоза. Число связанных с молекулами коллагена углеводных звеньев зависит от вида ткани и может колебаться в широких пределах от нескольких остатков до 110 в коллагене IV типа капсулы хрусталика глаза.
Г.Формирование тройной спирали проколлагена включает одновременное протекание нескольких процессов:
а) Каждая пептидная цепь проколлагена соединяется водородными связями с двумя другими цепями проколлагена.
б) Образуются внутрицепочечные дисульфидные связи между аминокислотными остатками цистеина на С- и N-концах молекул проколлагена.
в) Между С-концевыми последовательностями полипептидных цепей формируются межцепочечные дисульфидные связи.
После окончательной сборки тройной спирали дальнейшее гидроксилирование пролина и лизина, а также гликозилирование молекулы становятся невозможными.
На рисунке аминокислотные остатки глицина окрашены в черный цвет, а других аминокислот – в белый:
Д.Транспорт во внеклеточное пространство
После завершения внутриклеточного процессинга молекулы гликозилированного проколлагена перемещаются к наружной поверхности клетки через комплекс Гольджи, включаются в секреторные пузырьки и секретируются в межклеточное пространство экзоцитозом.
Дата добавления: 2020-10-01; просмотров: 672;











