СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ЦПЭ
Система ферментов и белков, обеспечивающая взаимосвязь (сопряжение) процессов окисления и фосфорилирования АДФ, получила название цепи переноса электронов (ЦПЭ) или дыхательной цепи.
В основе ЦПЭ лежит работа 3-х важнейших ферментативных комплексов.
· Первый ферментативный комплекс NADН-дегидрогеназа (I)представляет собой белок, имеющий простетическую группу – FMN, коферментом является рибофлавин (витамин В2). NADН-дегидрогеназа катализирует перенос 2Н с кофермента NADН на FMN, который переходит в форму FMNН2. Второй протон поглощается из матрикса. Реакция протекает по уравнению:
NADH + Н+ + Е (FMN) → NAD+ + Е (FMNH2)
С FMNH2 электроны переносятся затем на ряд железо-серных белков (FeS), играющих роль второй простетической группы в молекуле NADH-дегидрогеназы.
Атомы железа в таких белках могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри- (Fe3+) состояния. Затем электроны переносятся на кофермент Q (убихинон).
· Убихинон (кофермент Q10) – жирорастворимое витаминоподобное вещество, широко распространённое в клетках всех организмах. Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10. Убихинон способен восстанавливаться и превращаться в убихинол, имеющий 2 ОН-группы.
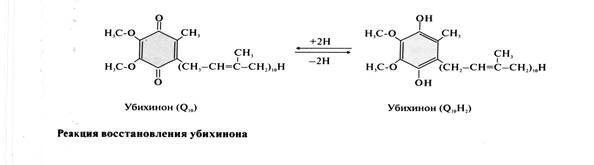
В реакции восстановления убихинон принимает от FMNН2 2е, таким образом в результате работы NADH-дегидрогеназы кофермент NADH переходит в окисленную форму.
NADH + Н+ + Q → NAD++ QH2.
· Ферментный комплекс QH2-дегидрогеназа (IIi)представляет сложный белок, включающий цитохромы (b1 и b2) и цитохром с1. В ЦПЭ участвуют 5 типов цитохромов (а, а3, b, с, с1). За исключением цитохрома с, все цитохромы находятся во внутренней мембране митохондрий в виде сложных белковых комплексов. Рабочей частью всех цитохромов является гемм, содержащий ион Fe2+, который может принимать электрон и менять валентность.
QН2-дегидрогеназа переносит электроны от убихинола на цитохром с. Внутри комплекса III электроны передаются от цитохромов b на FeS-центры, на цитохром с1, а затем на цитохром с. Группы гема, подобно FeS-центрам, переносят только по одному электрону. Таким образом, от молекулы QH2 2 электрона переносятся на 2 молекулы цитохрома b.
· Цитохромоксидаза (ферментный комплекс IV) состоит из 2 цитохромов а и а3, а также ионы меди, которые могут изменять свою валентность и участвуют в переносе электронов на кислород.
Cu+ ↔ Cu2+ + e,
Fe2+ ↔ Fe3+ + e.
Цитохромы а и а3 в восстановленной форме имеют высокое сродство к кислороду, который принимает два электрона и переходит в ионизированную форму. В активном центре цитохромоксидазы кислород присоединяет 2Н+ из матрикса и образуется молекула воды.
Работа комплекса IV цитохромоксидазы также сопровождается переносом Н+ из матрикса в межмембранное пространство (против градиента концентрации).
Таким образом, все ферментативные комплексы ЦПЭ, участвующие в передаче электронов, обеспечивают перекачивание Н+ из матрикса в межмембранное пространство.
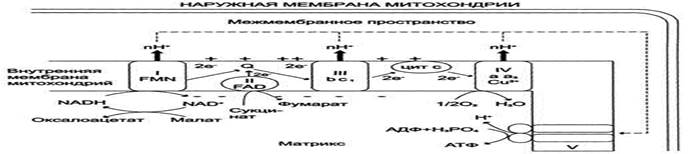
I - NADH-дегидрогеназа; II - сукцинат дегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза; V - АТФ-синтаза.
Повышение концентрации Н+ в межмембранном пространстве приводит к возникновению градиента электрохимического потенциала ΔμН+. Энергия ΔμН+ используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы.
Порядок участия ферментов в работе цепи обусловлен величиной их окислительно-восстановительного потенциала, который возрастает от одного компонента к другому.
| Компонент ЦПЭ | окислительно-восстановительный потенциал, Е0 |
| NAD+/ NADH | -0,32 |
| FMN//FMNH2 | -0,22 |
| Q/QH2 | +0,10 |
| Цитохром с | +0,25 |
| О2/Н2О | +0,82 |
Работу ЦПЭ объясняет хемиосмотическая теория Митчелла, основные положения которой объясняют механизмы сопряжения процессов биологического окисления и фосфорилирования АДФ.
При движении от окисляемого субстрата к кислороду электроны теряют часть своей энергии. Эту энергию ферменты ЦПЭ используют для переноса протонов из матрикса в межмембранное пространство против градиента концентрации, т.е. комплексы ЦПЭ работают как протонный насос, перекачивая Н+.
Градиент электрохимического потенциала стимулирует возвращение протонов из межмембранного пространства в матрикс. Но внутренняя мембрана митохондрий для Н+ непроницаема. Их перенос происходит с помощью фермента АТФ-синтазы (комплекс V), имеющего протонный канал F0. Н+ межмембранного пространства присоединяются к ферменту, изменяя его заряд и конформацию. Это приводит к раскрытию протонного канала, переносу Н+ в матрикс по градиенту концентрации и активации поверхностной части фермента, катализирующей реакцию образования АТФ.
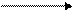 АДФ + Н3РО4 АТФ + Н2О
АДФ + Н3РО4 АТФ + Н2О
Образующиеся молекулы АТФ траспортируются из матрикса в цитозоль АДФ-АТФ-транслоказами, которые одновременно переносят АДФ в митохондрию.
Количество АТФ, образующееся в результате сопряжения работы ЦПЭ и АТФ-синтазы, оценивается с помощью коэффициент окислительного фосфорилирования.
Окисление молекулы NADH в ЦПЭ сопровождается образованием 3 молекул АТФ; энергия электронов и протонов в ЦПЭ от FAD-зависимых дегидрогеназ (сукцинатдегидрогеназа), достаточна для активации АТФ-синтазы и фосфорилирования 2 молекул АТФ. Отношение количества фосфорной кислоты (Р), использованной на фосфорилирование АДФ, к атому кислорода (О), поглощённого в процессе дыхания, называют коэффициентом окислительного фосфорилирования и обозначают Р/О. Следовательно, для NADH Р/О = 3, для сукцината Р/О - 2.
Для синтеза АТФ используется не вся энергия, выделяющаяся в процессе переноса электронов и протонов в ЦПЭ, а примерно 40-50%. Более 30% всей энергии выделяется в виде тепла, обеспечивая поддержание температуры тела человека. Остальная энергия используется для работы клеток (например, для транспорта веществ через мембрану).
Биологические функции ЦПЭ
· Использует энергию окисления субстратов для синтеза АТФ путем окислительного фосфорилирования
· Обеспечивает поддержание температуры тела
В норме скорость окисления первичных доноров Н+ и электронов регулируется содержанием АДФ. Выполнение клеткой работы с затратой АТФ приводит к накоплению АДФ, это активирует окисление субстратов и поглощение кислорода митохондриями клетки.
Таким образом, клетки реагируют интенсивность метаболизма и поддерживают соотношение АТФ/АДФ на необходимом уровне. Зависимость интенсивности поглощения кислорода от концентрации АДФ называется дыхательным контролем.
Механизм дыхательного контроля характеризуется высокой точностью и имеет важное значение, так как в результате его действия скорость синтеза АТФ соответствует потребностям клетки в энергии. Запасов АТФ в клетке не существует. Относительные концентрации АТФ/АДФ в тканях изменяются в узких пределах, в то время как потребление энергии клеткой, т.е. частота оборотов цикла АТФ и АДФ, может меняться в десятки раз.
Транспорт АТФ и АДФ через мембраны митохондрий
В большинстве эукариотических клеток синтез АТФ происходит внутри митохондрии, а основные потребители АТФ расположены вне её. С другой стороны, в матриксе митохондрий должна поддерживаться достаточная концентрация АДФ. Эти заряженные молекулы не могут самостоятельно пройти через липидный слой мембран. Внутренняя мембрана непроницаема для заряженных и гидрофильных веществ, но в ней содержится определённое количество транспортёров, избирательно переносящих подобные молекулы из цитозоля в матрикс и из матрикса в цитозоль.
В мембране есть белок АТФ/АДФ-антипортер, осуществляющий перенос этих метаболитов через мембрану.
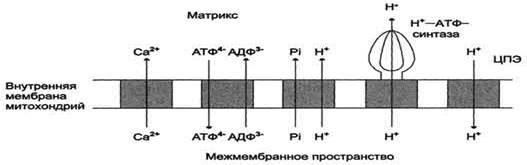
Потоки различных веществ (АТФ, АДФ, Н3РО4, Са2+) проходят через специфические транспортёры, при этом затрачивается энергия электрохимического потенциала мембраны.
Молекула АДФ поступает в митохондриальный матрикс только при условии выхода молекулы АТФ из матрикса.
Движущая сила такого обмена - мембранный потенциал переноса электронов по ЦПЭ. Расчёты показывают, что на транспорт АТФ и АДФ расходуется около четверти свободной энергии протонного потенциала. Другие транспортёры тоже могут использовать энергию электрохимического градиента. Так переносится внутрь митохондрии неорганический фосфат, необходимый для синтеза АТФ. Непосредственным источником свободной энергии для транспорта Са2+ в матрикс также служит протонный потенциал, а не энергия АТФ.
Дата добавления: 2020-10-01; просмотров: 1263;











