Применение биокатализаторов на основе иммобилизованных клеток
Рассматривая примеры, иллюстрирующие степень сложности процессов катализа с участием иммобилизованных клеток, мы начнем с самого простого случая и постепенно будем переходить ко все более и более сложным случаям. Путем иммобилизации целых клеток, предварительно обработанных с целью повышения их проницаемости литическими ферментами, спиртами или диметилсульфоксидом (ДМСО), мы, по сути дела, иммобилизуем входящие в их состав индивидуальные ферменты, в той или иной мере сохраняя их естественное окружение; такие катализаторы в принципе пригодны для использования в непрерывных процессах. К настоящему времени получено большое число катализаторов типа «иммобилизованные ферменты в иммобилизованных клетках»; некоторые из этих катализаторов нашли применение в промышленности. Такой подход к иммобилизации ферментов проще, чем выделение ферментов из клеток с последующей иммобилизацией. С точки зрения практического использования, по-видимому, важнее другое преимущество иммобилизованных клеток, заключающееся в возможном повышении стабильности ферментов.
На рис. 28 представлены результаты экспериментов по изучению инактивации аспартазы и фумаразы в иммобилизованных клетках Е. coli и в суспендированных интактных клетках того же организма. В иммобилизованных клетках инактивация как первого, так и второго ферментов происходит значительно медленнее. Возможно, что отчасти эта стабильность является кажущейся и обусловлена ограничениями ферментативных процессов за счет сопротивления массопереносу.

РИС. 28. Инактивация аспартазы и фумаразы в суспендированных и иммобилизованных клетках. (Воспроизведено с разрешения из работы: Immobilized Enzymes, Chibata I. (ed.), p. 140, Kodansha Ltd., Tokyo, 1978.)
Действительно, если катализатор на основе иммобилизованных клеток (или ферментов) функционирует в режиме, строго лимитируемом диффузией, то наблюдаемая скорость инактивации будет значительно ниже действительной скорости этого процесса. Однако в дальнейших экспериментах Шибата и др. показали, что в данном конкретном случае имеет место истинная стабилизация фермента вследствие его включения в нативное клеточное окружение. Интактные клетки Е. coli были обработаны ультразвуком, затем растворимая и нерастворимая фракции продуктов обработки были разделены и иммобилизованы. В иммобилизованной растворимой фракции аспартазная активность снижалась значительно быстрее, чем в иммобилизованной нерастворимой фракции. Кроме того, обработкой интактных клеток агентами, солюбилизирующими связанные с мембранами белки (дезоксихолатом или тритоном Х-100), также были получены растворимая и нерастворимая фракции, которые после иммобилизации быстро теряли активность. Эти результаты свидетельствуют о возможности стабилизации аспартазы путем связывания или ассоциации с клеточными мембранами или с их компонентами. Следует отметить, однако, что в других случаях иммобилизация ферментов в интактных клетках сопровождается и обратным эффектом. Так, в проницаемых иммобилизованных клетках некоторых организмов глюкозоизомераза теряет активность быстрее, чем тот же самый фермент, выделенный из этих клеток. Этот эффект объясняли протеолизом фермента под действием внутриклеточных ферментов.
Проблема внутриклеточной протеолитической активности очень важна при любом применении иммобилизованных клеток. Как мы упоминали в гл. 6, для нормальной жизнедеятельности клеткам необходимы внутриклеточные гидролазы. Очевидно, что потеря ферментативной активности в результате внутриклеточного гидролиза, а также разрушение клеточной мембраны или утрата клеткой способности транспортировать вещества за счет какого-либо другого процесса играют основную роль в определении полезного времени жизни катализатора на основе иммобилизованных клеток. Для оптимизации генетической природы клеток и разработки более совершенных катализаторов на основе иммобилизованных клеток, соответствующих конструкций реакторов и оптимальных режимов их эксплуатации, очевидно, необходимо лучше понимать механизмы процессов внутриклеточного гидролиза, а также других процессов инактивации, связанных с изменением конформаций белковых молекул или с повреждением мембран вследствие химического взаимодействия с компонентами среды. Действительно, на разработку штаммов микроорганизмов, успешно применяющихся в настоящее время в культурах суспензий клеток, были затрачены десятилетия; в этой связи представляется вполне вероятным, что для получения генетически модифицированных штаммов, специально предназначенных для их использования в иммобилизованной форме, потребуются еще очень большие усилия.
Следующий по степени сложности уровень каталитической активности включает многостадийные превращения, связанные с использованием и регенерацией кофакторов. Из процессов такого типа наиболее широко изучалось превращение глюкозы в анаэробных условиях. Много работ посвящено изучению превращения глюкозы в этанол иммобилизованными дрожжами (Saccharomyces cerevisiae) или бактериями (в первую очередь Zymomonas mobilis); по меньшей мере один процесс с участием биокатализаторов на основе иммобилизованных клеток реализован на пилотной установке.
Изучению превращения глюкозы в этанол при участии иммобилизованных клеток предшествовали работы по исследованию непрерывных процессов пивоварения в присутствии склонных к флокуляции штаммов дрожжей; по сути дела, флокуляция обеспечивает достаточно эффективное удерживание (иммобилизацию) клеток в реакторе с псевдоожиженным слоем катализатора. Позднее дрожжи иммобилизовали путем адсорбции на желатиновой пленке и включения в n-каррагинан, альгинат или полиакриламид. Показано, что для реактора колонного типа с клетками Saccharomyces carlsbergensis, иммобилизованными в х-каррагинане, характерен стартовый период с неустановившимся режимом, продолжающийся около 7 сут, после чего колонна функционирует в стационарном режиме с постоянными концентрациями жизнеспособных клеток в геле, а также глюкозы и этанола в продуктах процесса. После ряда конструкционных доработок концентрацию этанола в продуктах процесса удалось довести до 100 г/л и более.
Японская компания Kyowa Накко Kogyo Company сообщила о создании пилотной установки для производства этанола с помощью иммобилизованных дрожжей в реакторе с псевдоожиженным слоем катализатора. Схема этой установки представлена на рис. 29. После трехмесячных испытаний удалось найти режим, при котором разбавленная меласса сахарного тростника (содержащая 14% глюкозы) при 30 °C превращалась в 8,5%-ный (по объему) водный этанол с объемной скоростью [(объем раствора исходных веществ) · (объем геля)-1·ч-1] от 0,4 до 0,5 ч-1. Степень превращения сахара в этанол составляла 95%, а производительность установки в расчете на единицу объема колонны 20 г/ (л·ч).
 Более сложен процесс превращения глюкозы в ацетон, бутанол и этанол с помощью бактерии Clostridium acetobutylicum и родственных организмов. Пути катаболизма в этой бактерии
Более сложен процесс превращения глюкозы в ацетон, бутанол и этанол с помощью бактерии Clostridium acetobutylicum и родственных организмов. Пути катаболизма в этой бактерии
контролируются сложной регуляторной системой, которая до настоящего времени детально не изучена, несмотря на большой практический опыт по применению этого организма в традиционных ферментациях с участием суспендированных культур.
РИС. 29. Схема установки для производства этанола с помощью иммобилизованных дрожжей.
В зависимости от состава и условий среды и состояния клеток в одних случаях основными конечными продуктами метаболизма глюкозы могут быть органические кислоты, а в других образуются необходимые органические растворители. По сравнению с катализируемым дрожжами превращением глюкозы в этанол эта система значительно сложнее, поскольку здесь мы должны уметь регулировать селективность процесса, направляя его в сторону образования ценных веществ.
Возможность практической реализации непрерывного длительного процесса биопревращения глюкозы в органические растворители была продемонстрирована Фёрбергом и др. В разработанном ими процессе катализатором служил организм Cl. acetobutylicum, включенный в гель на основе альгината кальция, а глюкозная среда была лишена факторов, необходимых для клеточного роста. Время от времени, сначала с интервалом 2—4 ч, а затем через каждые 8 ч в культуру вводили полную питательную среду, что позволяло регенерировать частично инактивированный катализатор. Сообщалось, что в таком режиме, сочетающем не связанное с клеточным ростом многостадийное биологическое превращение с короткими периодами полного клеточного роста, система устойчиво функционировала в течение 8 недель. В этом процессе существенно подавлялось образование биомассы, а выход бутанола в расчете на единицу массы утилизированной глюкозы был значительно выше, чем в процессе, в котором иммобилизованные клетки контактировали с полной средой.
В табл. 9 сравниваются важнейшие параметры процессов с использованием иммобилизованных клеток в полной среде, иммобилизованных клеток с чередованием сред (обеспечивающих только клеточный рост или только превращение субстрата), а также обычного периодического процесса с суспензией бактерий.
Таблица 9. Выход бутанола в расчете на единицу клеточной массы, массы субстрата или объема культуры с участием иммобилизованныха и суспендированныха клеток
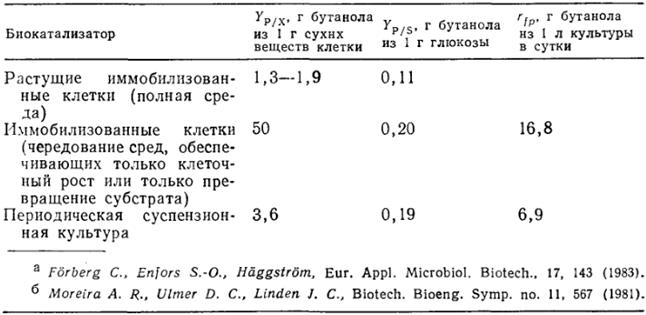
Очевидно, что для дальнейшего совершенствования катализаторов на основе иммобилизованных клеток необходимы фундаментальные исследования и проектные разработки. Вместе с тем приведенный пример достаточно наглядно свидетельствует о возможности изменения кинетики и стехиометрии процесса путем подбора типа катализатора и соответствующего режима; этот путь создает дополнительные возможности для управления биокаталитическими процессами и их оптимизации.
Пока что в области применения иммобилизованных клеток для биосинтеза продуктов метаболизма и биополимеров успехи не очень велики. Это и не удивительно, если принять во внимание указанные выше осложнения и тот факт, что разработка методов осуществления многостадийных превращений, катализируемых иммобилизованными клетками, по сути дела, пока еще только начинается.
В табл. 10 перечислены некоторые результаты экспериментального изучения методов биосинтеза ряда веществ с участием иммобилизованных клеток. В некоторых из приведенных примеров рост клеток был существенно ограничен, в других для расширения периода активной жизни клеток применялось чередование фаз полного клеточного роста и подавления роста, а в третьих рост клеток вообще не ограничивался. Разумеется, при росте клеток с некоторой ограниченной скоростью должны иметь место вымывание или лизис клеток, причем скорость этих процессов должна уравновешиваться скоростью клеточного роста; в противном случае не будет достигнуто стационарное состояние. При культивировании на твердых поверхностях клеток тканей животных регуляторные механизмы останавливают рост клеток примерно на стадии монослоя и затем переключают метаболизм с роста на образование продуктов метаболизма. Однако для достижения идеала — системы с иммобилизованными клетками, способной синтезировать сложные вещества с высокими выходом и скоростью в проточных реакторах, — нам еще предстоит исследовать множество проблем.
Дата добавления: 2020-10-01; просмотров: 665;











