Нефротический синдром
Этим термином обозначается симптомокомплекс, характеризующийся массивной протеинурией(более 3 г белка/сутки), гипо- и диспротеинемией, гиперлипидемией, гиперхолестеринемией, распространенными отеками и водянкой серозных полостей.
По этиологииразличают первичный и вторичный нефротический синдром. Причиной развития первичного нефротического синдромаявляются первично возникающие заболевания почек, такие, как гломерулопатия с минимальными изменениями в виде слияния малых ножек подоцитов (липоидный нефроз), мембранозный гломерулонефрит, фокально-сегментарный гломерулосклероз, мембранозно-пролиферативный гломерулонефрит.
Вторичный нефротический синдромвозникает при многих заболеваниях, в основном системного характера, при которых почки поражаются вторично. К числу таких заболеваний относятся сахарный диабет (диабетическая нефропатия), амилоидоз, злокачественные опухоли, коллагенозы (системная красная волчанка, склеродермия, ревматизм, узелковый периартериит), хронические инфекционные процессы в организме, паразитарные заболевания
(токсоплазмоз, шистоматоз и др.), аллергические заболевания (сывороточная болезнь и др.). Кроме этого вторичный нефротический синдром возникает при интоксикациях (золото, ртуть, висмут, пенициламин, нестероидные противовоспалительные средства, яды насекомых и змей), нефропатии беременных, тромбозе почечных сосудов и др.
Этиология нефротического синдрома в значительной степени зависит от возраста. Наиболее частой причиной развития этого синдрома у детей является нефропатия с минимальными изменениями; у взрослых среди причин развития нефротического синдрома на первом месте стоит мембранозный гломерулонефрит; у людей старше 60 лет, наряду с мембранозным гломерулонефритом, развитие нефротического синдрома во многих случаях связано с диабетической нефропатией и другими системными заболеваниями, вторично нарушающими функцию почек.
Патогенез.Во всех случаях нефротического синдрома имеет место повышенная проницаемость базальной мембраны капилляров клубочков для белка. Протеинурияможет иметь как селективный, так и неселективный характер. При нефротическом синдроме с минимальными изменениями повышение клубочковой проницаемости связано с уменьшением постоянного электрического заряда стенки капиллярных петель, что обусловлено исчезновением из нее сиалопротеида, в норме тонким слоем покрывающего эндотелий и отростки подоцитов, лежащих на базальной мембране. При мембранозном гломерулонефрите главную роль играет потеря функции барьера, зависящего от размера пор в базальной мембране, которые в норме ограничивают прохождение плазменных белков с молекулярной массой более 150 кД.
Повышение проницаемости фильтрующих мембран клубочков связывают с повреждающим действием откладывающихся на них иммунных комплексов, а также лизосомальных ферментов и активных форм кислорода, выделяемых нейтрофилами и моноцитами. Кроме того, в плазме крови больных с нефротическим синдромом обнаружен фактор, предположительно образуемый лимфоцитами, который повышает проницаемость клубочкового барьера. При любом механизме повреждения происходит повышенное поступление белков плазмы крови, преимущественно альбуминов, в клубочковый фильтрат, и развивается резко выраженная протеинурия (более 3 г белка/сутки, в отдельных случаях - до 50 г белка/сутки). Следствием этого является гипопротеинемия(менее 60 г белка/л),
главным образом за счет снижения содержания альбуминов. Вызываемое гипопротеинемией падение коллоидно-осмотического давления сопровождается усиленным выходом жидкости из сосудов в межклеточное пространство и серозные полости тела и развитием гиповолемии, что, в свою очередь, вызывает повышение активности РААС и усиление продукции альдостерона; последний снижает экскрецию натрия с мочой и увеличивает его концентрацию в крови. При проведении ряда клинических и экспериментальных исследований было установлено, что, кроме описанного механизма, развитию гипернатриемии при нефротическом синдроме способствует снижение реакции почек на действие предсердного натрийдиуретического пептида, стимулирующего выведение натрия с мочой. Установлено, что пониженная реакция нефротической почки на предсердный натрийуретический пептид обусловлена пострецепторным дефектом в механизме действия этого фактора на уровне канальцевого эпителия. Возникающее при этом повышение осмотического давления стимулирует секрецию АДГ, который усиливает задержку в организме воды, что ведет к развитию отеков (рис. 19-2).
Стимуляция секреции АДГ под действием гипернатриемии сопровождается увеличением объема плазмы крови, но происходит ее разжижение, гипопротеинемия и гипоонкия возрастают. Вследствие этого избыточная вода не задерживается в кровеносном русле, а перемещается в ткани, что способствует дальнейшему нарастанию отеков, т.е. возникает «порочный круг».
Развитию гипопротеинемии при нефротическом синдроме, кроме протеинурии, способствуют повышенный выход белка в ткани в составе транссудата и потеря его через отечную слизистую кишечника. Гипопротеинемия сочетается с диспротеинемией,так как наряду с альбуминами нередко снижается содержание в крови γ-глобулинов, которые также могут поступать в мочу. Вместе с тем развивается гиперлипидемияза счет повышения содержания липопротеинов низкой и очень низкой плотности (ЛПОНП) при нормальном или пониженном уровне липопротеинов высокой плотности. В плазме крови повышается содержание холестерина и триацилглицеролов. За развитие гиперлипидемии ответственны два механизма: повышение продукции липопротеинов в печени и нарушение катаболизма хиломикронов и ЛПОНП. Предполагается, что пониженный катаболизм липопротеинов может быть обусловлен потерей с мочой некоторых субстанций (например, ли-
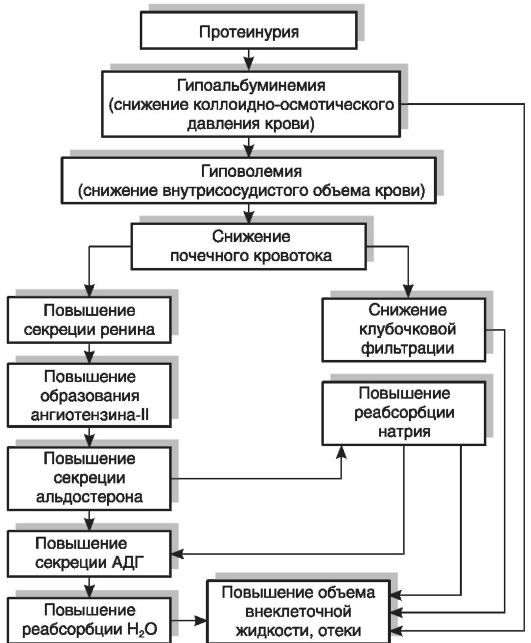 Рис. 19-2.Механизм развития отеков при нефротическом синдроме. АДГ - антидиуретический гормон
Рис. 19-2.Механизм развития отеков при нефротическом синдроме. АДГ - антидиуретический гормон
попротеиновой липазы). Однако ни один из компонентов, выделенных из мочи этих больных, полностью не устраняет нарушения обмена липопротеинов. Гиперхолестеринемия и гиперлипидемия повышают риск развития у таких пациентов сердечно-сосудистых нарушений.
При нефротическом синдроме многие транспортные белки, связывающие эндогенные и экзогенные субстанции, теряются с мочой. В связи с этим в плазме крови у больных с нефротическим синдромом понижен уровень ряда микроэлементов (Fe, Cu
и Zn), метаболитов витамина D, тареоидньгх и стероидных гормонов. Многие лекарства в плазме крови связаны с альбуминами, поэтому при гипоальбуминемии повышается количество свободно циркулирующих форм, что может повысить их токсичность.
Развитие обширных отеков(вплоть до отека легких и мозга) и накопление транссудата в серозных полостях могут сопровождаться тяжелыми нарушениями функции жизненно важных органов и стать причиной летального исхода. Наряду с этим при нефротическом синдроме возникает ряд осложнений, являющихся факторами риска для таких больных.
Главную опасность при нефротическом синдроме составляют тромбоэмболические осложнения.У больных мембранозным гломерулонефритом часто возникает тромбоз почечной вены (у 20-30% взрослых пациентов); нередко происходит тромбоз глубоких вен голени. Другим опасным осложнением является эмболия легочной артерии. Артериальные тромбозы менее часты, но они могут привести к нарушению коронарного кровообращения, что повышает риск развития инфаркта миокарда. Главными факторами, ответственными за состояние гиперкоагуляции при нефротическом синдроме, являются повышение содержания прокоагулянтов - фибриногена и плазменных факторов V и VIII, снижение содержания антикоагулянта антитромбина III, ослабление активности фибринолитической системы вследствие снижения содержания плазминогена и повышение активности а2-антиплазмина; кроме того, происходит увеличение количества тромбоцитов и повышается их способность к адгезии и агрегации, что способствует нарушению микроциркуляции в различных органах и тканях.
Другую опасность для больных с нефротическим синдромом представляют инфекционные осложнения. Ранее дети с этим синдромом умирали от бактериальной инфекции, в частности от пневмококкового перитонита. Повышенная чувствительность к бактериальной инфекции обусловлена снижением уровня иммуноглобулинов А и G вследствие потери их с мочой.
Нередко происходит развитие гипокалыщемии,что обусловлено потерей с мочой связанного с белком кальция и метаболитов витамина D и снижением продукции этого витамина в проксимальных канальцах нефронов. Следствием гипокальциемии является развитие гиперпаратиреоза и остеопороза.Из других осложнений следует указать на возможность развития острой почечной недостаточности в связи с резко выраженной гиповолемией.
Ренальные показатели при нефротическом синдроме в значительной степени зависят от заболевания, на фоне которого он развился. В наиболее чистом виде они выражены при нефропатии с минимальными изменениями. При этом состоянии развивается олигурия,относительная плотность мочи повышена (1030-1050); кроме массивной протеинурии, регистрируется липидурия;в осадке мочи обнаруживаются гиалиновые, восковидные и эпителиальные цилиндры с жировыми включениями. При других вариантах нефротического синдрома в осадке мочи могут присутствовать эритроциты и лейкоциты. Массивная протеинурия повреждает эпителий канальцев, и это может сопровождаться развитием глюкозурии, гипераминоацидурии, фосфатурии, почечного канальцевого ацидоза; возникает состояние, подобное синдрому де Тони- Дебре-Фанкони.
Считается, что прогноз нефротического синдрома благоприятен при нефропатии с минимальными изменениями (при условии своевременно начатого лечения). При нефротическом синдроме другой этиологии исход зависит от вида заболевания, возникших осложнений, возраста пациента, своевременности и правильности лечения.
Дата добавления: 2016-07-11; просмотров: 3855;











