Анемии вследствие нарушения кровообразования
Группа анемий, объединенных одним общим механизмом развития, который заключается в нарушении или полном прекращении эритропоэза в результате дефицита веществ, необходимых для осуществления нормального кроветворения, носит название дефицитных анемий.Сюда относят дефицит микроэлементов (железо, медь, кобальт), витаминов (В12, B6, В2, фолиевая кислота) и белков.
При замещении костномозговой полости жировой, костной или опухолевой тканью (метастазы опухолей в костный мозг, лейкоз), а также при действии физических (ионизирующая радиация) и химических факторов, некоторых микробных токсинов и лекарственных препаратов развиваются анемии в результате сокращения площади кроветворения.
Железодефицитные анемии.Анемии, обусловленные дефицитом железа в организме, относятся к числу наиболее распространенных заболеваний в мире и составляют 80-95% всех форм малокровия. Наиболее часто они встречаются у детей младшего возраста, девушек-подростков и женщин детородного возраста.
Этиология. Железодефицитная анемия может быть обусловлена самыми разнообразными причинами: недостаточным поступлением железа с пищей, нарушением всасывания его в тонком кишеч-
нике, повышенной потребностью в период роста, беременностью, лактацией, кровотечениями из различных органов и др. Однако наиболее частой причиной железодефицитной анемии являются кровопотери и в первую очередь длительные постоянные кровотечения даже с небольшими потерями крови. В этих случаях количество теряемого железа превышает его поступление с пищей. Дефицит железа в организме развивается при суточной потере его в количестве, превышающем 2 мг. Схема метаболизма железа представлена на рис. 14-5.
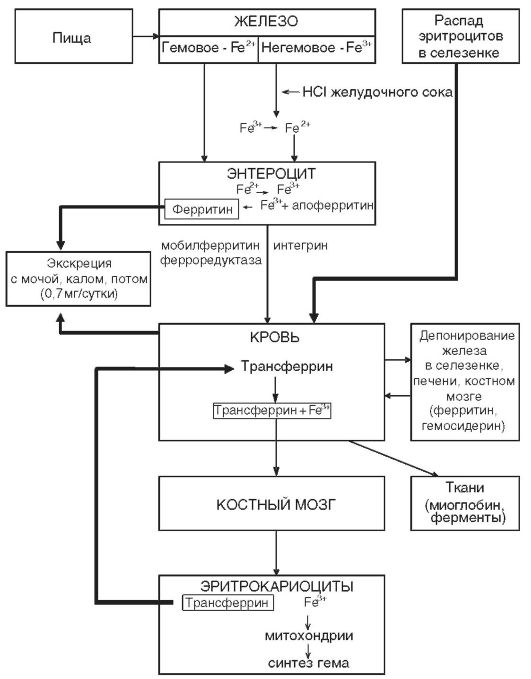 Рис. 14-5.Схема метаболизма железа в организме
Рис. 14-5.Схема метаболизма железа в организме
По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп (Л.И. Идельсон): 1) связанные с повышенной потерей железа; 2) связанные с недостаточным исходным уровнем железа; 3) связанные с повышенным расходованием железа; 4) связанные с нарушением всасывания железа и недостаточным поступлением его с пищей (алиментарные); 5) связанные с нарушением транспорта железа (табл. 14-4).
Таблица 14-4.Причины и механизмы развития железодефицитных состояний
| Этиологические факторы | Патогенез | |
| группы факторов | характеристика | |
| Особенные периоды жизни | Дети недоношенные и новорожденные Дети первых лет жизни | Недостаточный исходный уровень железа |
| Интенсивный рост (пубертатный период) Беременность Лактация | Повышенное расходование железа | |
| Патологические состояния | Хроническая кровопотеря: при частых лечебных кровопусканиях, донорстве; при заболеваниях сердечнососудистой системы (гипертоническая болезнь, геморрагическая телеангиэктазия и др.); при патологии желудочнокишечного тракта (варикозное расширение вен пищевода, диафрагмальная грыжа, язва желудка и двенадцатиперстной кишки, язвенный колит, дивертикулез, геморрой и др.); из органов мочеполовой системы (алкогольная нефропатия, туберкулез почек, почечнокаменная болезнь, полипы и рак мочевого пузыря, обильные меноррагии, эндометриоз, миома матки и др.); из органов дыхательной системы (рак легкого, туберкулез, бронхоэктазия и др.); | Повышенная потеря железа |
Окончание табл. 14-4
| при заболеваниях системы крови (лейкозы, апластическая анемия и др.); при патологии системы гемостаза (аутоиммунная тромбоцитопения, гемофилии, ДВС-синдром и др.) | ||
| Патологические состояния и болезни | Патология желудочно-кишечного тракта: резекция желудка и кишечника; гипосекреция желудочного сока; хронический энтерит; дисбактериозы; глистные инвазии и др. | Нарушение всасывания железа |
| Наследственная атрансферринемия Приобретенная гипотрансферринемия (при нарушении белоксинтезирующей функции печени) | Нарушение транспорта железа | |
| Алкоголизм | Комбинация факторов: недостаточное поступление железа; нарушение транспорта железа; нарушение всасывания железа; потеря железа | |
| Неблагоприятные воздействия | Нерациональное питание: голодание; вегетарианская диета; искусственное вскармливание грудных детей | Недостаточное поступление железа |
| Избыточные физические нагрузки | Повышенное расходование железа |
Патогенез. Основным звеном патогенеза заболевания является снижение содержания железа в сыворотке крови, костном мозгу и депо. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость и вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мы-
шечная слабость и др. (сидеропенический синдром Вальденстрема). В патогенезе клинических проявлений болезни в еще большей степени, чем недостаточное снабжение тканей кислородом, имеет значение нарушение активности железосодержащих ферментов в тканях организма (цитохром С, цитохромоксидаза, сукцинатдегидрогеназа, пероксидаза, митохондриальная моноаминооксидаза, α-глицерофосфатоксидаза). Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Картина крови. Основным признаком железодефицитной анемии является гипохромия со снижением цветового показателя ниже 0,8 и, соответственно, уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным до (2,0-1,5)-1012/л вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозгу и усиления неэффективного эритропоэза (в норме разрушение эритронормобластов в костном мозгу не превышает 10-15%). Содержание ретикулоцитов колеблется в пределах нормы, но при значительной кровопотере бывает несколько повышенным. Важным морфологическим признаком железодефицитных анемий является анизоцитоз эритроцитов с преобладанием микроцитов.
В костном мозгу отмечаются нарушение процессов гемоглобинизации эритрокариоцитов, сопровождающееся увеличением количества базофильных и полихроматофильных нормобластов при параллельном снижении числа их оксифильных форм, а также резкое уменьшение количества сидеробластов - нормобластов, содержащих единичные гранулы железа в цитоплазме (в норме до 20-40%).
В диагностике железодефицитной анемии решающее значение имеют показатели обмена железа (сывороточное железо, железосвязывающая способность сыворотки, общий запас железа в организме и др.). Количество железа в сыворотке крови при выраженной железодефицитной анемии падает до 5,4-1,8 мкМ/л при норме 12,5-30,4 мкМ/л (мужчины; у женщин этот показатель на 10-15% ниже). Увеличивается железосвязывающая способность сыворотки. В норме одна треть трансферрина насыщена железом, а две трети - свободны. Под общей железосвязывающей способностью сыворотки понимается не абсолютное количество трансферрина, а коли-
чество железа, которое может связаться с трансферрином (в норме 54,0-72,0 мкМ/л). Содержание ферритина в сыворотке крови, по результатам радиоиммунологических методов исследования, при железодефицитных анемиях снижается до 9,0-1,5 мкг/л (в норме - 12-300 мкг/л). Об уровне депонированного железа можно судить по содержанию железа в суточной моче после однократного введения больному 500 мг десферала (продукт метаболизма актиномицетов, избирательно выводящий ион железа из организма). В норме этот показатель соответствует 0,6-1,3 мг железа, а при железодефицитной анемии снижается до 0,2 мг в сутки и менее.
В12-дефицитные и фолиеводефицитные анемии.Витамин В12 и фолиевая кислота - кофакторы синтеза ДНК. Их дефицит сопровождается нарушением процессов пролиферации клеток с высоким кругооборотом - клеток крови, клеток кишечного эпителия и как следствие развитием анемии, характеризующейся наличием в костном мозгу мегалобластов, расстройствами пищеварения. Сочетанный дефицит витамина В12 и фолиевой кислоты встречается редко, чаще наблюдается изолированный дефицит витаминов.
Этиология. Дефицит витамина В12 чаще развивается в результате нарушения его всасывания при снижении секреции внутреннего фактора Касла (рис. 14-6) вследствие атрофии слизистой желудка либо после резекции желудка (агастрические анемии). У большинства больных с дефицитом витамина В12 обнаруживаются антитела, направленные против обкладочных клеток желудка и внутреннего фактора Касла. В12- и фолиеводефицитные состояния могут развиваться также при инвазии широким лентецом, поглощающим большое количество витамина В12, при беременности, нарушении всасывания витамина В12 в кишечнике, реже - при недостатке поступления с пищей (табл. 14-5).
Таблица 14-5.Причины развития мегалобластных анемий


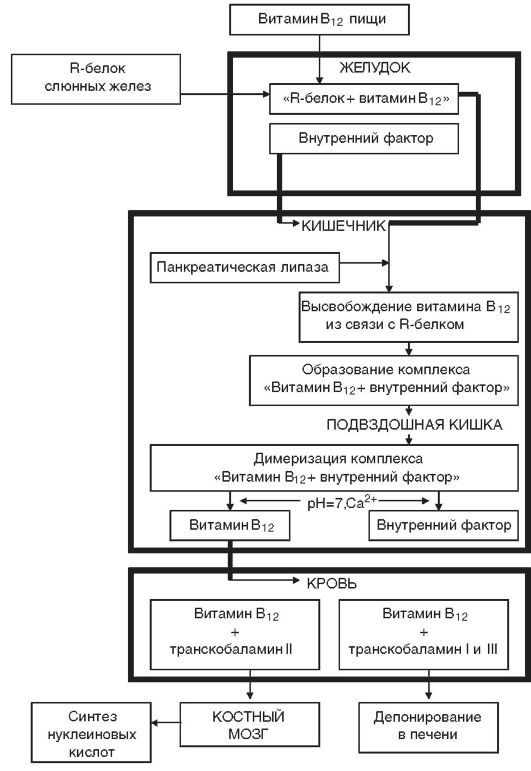 Рис. 14-6.Схема метаболизма витамина В12 в организме
Рис. 14-6.Схема метаболизма витамина В12 в организме
Пернициозная анемия (болезнь Аддисона-Бирмера). Представляет собой одну из форм заболевания, связанного с дефицитом фактора Касла и связанной с ним недостаточностью витамина В12. Различают наследственную и приобретенную формы болезни (см. табл. 14-5). Приобретенная форма анемии чаще развивается у лиц пожилого возраста (в среднем в возрасте 60 лет), редко встречается у детей в возрасте до 10 лет (ювенильная форма). Заболевание характеризуется поражением трех систем: пищеварительной (воспаление и атрофия сосочков языка, гистаминрезистентная ахилия, связанная с глубокой атрофией слизистой желудка, в peзультате чего железы дна и тела желудка прекращают выработку внутреннего фактора Касла - гастромукопротеина), нервной (фуникулярный миелоз - дегенерация задних и боковых столбов спинного мозга, нарушение кожной и вибрационной чувствительности, мышечно-суставного чувства, изменение ахилловых, коленных и др. рефлексов) и кроветворной (гиперхромная макроцитарная мегалобластическая анемия).
Патогенез. Расстройства пищеварения и переход на мегалобластический тип кроветворения обусловливаются резким снижением активности В12-зависимых энзимов, участвующих в метаболизме фолатов (соли фолиевой кислоты), необходимых для синтеза ДНК. При этом обнаруживается yменьшение активности метилтрансферазы, сопровождающееся кумуляцией в клетках неактивного метилтетрагидрофолата и нарушением синтеза ДНК (синтез РНК не страдает) (рис. 14-7), что приводит к удлинению S-фазы клеточного цикла и патологии деления и созревания эпителиальных клеток желудочно-кишечного тракта и миелокариоцитов. В костном мозгу развивается мегалобластоз.
Нарушение кроветворения связано с замедлением темпа мегалобластического эритропоэза в результате удлинения времени митотического цикла и сокращения числа митозов: вместо трех митозов, свойственных нормобластическому эритропоэзу, регистрируется только один. Срок жизни эритроцитов сокращается до 30-40 дней (в норме - 90 дней). Часть клеток погибает на ранних стадиях развития. Распад мегалобластов в костном мозгу, наряду с их замедленной дифференциацией, и мегалоцитов в крови приводит к тому, что процессы кроветворения не компенсируют процессы кроверазрушения. Развивается мегалобластическая анемия.
В основе неврологических расстройств (фуникулярный миелоз) лежит нарушение превращения метилмалонил-КоА в сукцинил-
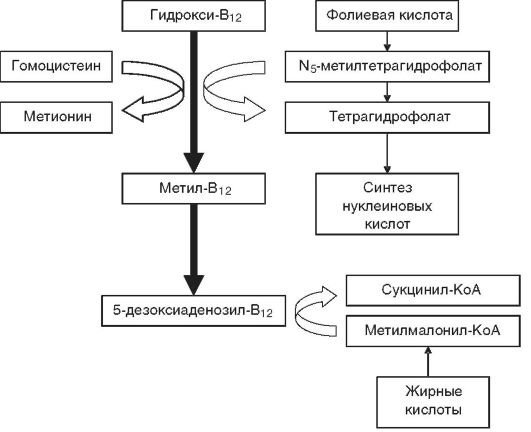 Рис. 14-7.Схема биохимических реакций, протекающих в организме с участием витамина В12 и фолиевой кислоты (по В.В. Долгову и соавт., 2001)
Рис. 14-7.Схема биохимических реакций, протекающих в организме с участием витамина В12 и фолиевой кислоты (по В.В. Долгову и соавт., 2001)
КоА при недостатке 5-дезоксиаденозил-В12 (см. рис. 14-7) и накопление в нервной ткани токсичных метилмалоновой и пропионовой кислот, вызывающих жировую дистрофию нервных клеток и демиелинизацию нервных волокон спинного мозга и периферических нервов.
При монодефиците фолиевой кислоты нарушения метаболизма жирных кислот в нервной ткани, а следовательно, признаки неврологических расстройств отсутствуют.
Картина крови. В периферической крови обнаруживаются гиперхромная анемия (цветовой показатель 1,2-1,5), явления пойкилоцитоза с тенденцией к овалоцитозу, анизоцитоза с выраженным макроцитозом и мегалоцитозом. Характерны явления анизохромии и гиперхромии эритроцитов; могут обнаруживаться полихроматофильные и оксифильные мегалобласты, эритроциты с тельцами Жолли, кольцами Кабо, азурофильной зернистостью. Средний диаметр эритроцитов увеличивается до 8,2-9,5 мкм, их средний объем превышает 100 фл (110-160 фл). Регистрируется умеренная лей-
копения с нейтропенией при полном отсутствии малочисленных форм гранулоцитов - эозинофилов и базофилов (анэозинофилия, абазофилия). Встречаются гиперсегментно-ядерные нейтрофилы (дегенеративный ядерный сдвиг вправо), редко - гигантские формы нейтрофилов. Количество тромбоцитов уменьшается, часть их имеет крупные размеры (6-10 мкм и более).
Костный мозг гиперклеточный за счет накопления незрелых (негемоглобинизированных) ядросодержащих форм клеток красного ряда. На препаратах костного мозга обнаруживаются мегалоциты и мегалобласты, гигантские формы метамиелоцитов.
Гипо- и апластические анемии.Гипопластические анемии относятся к числу анемий, обусловленных депрессией костно-мозгового кроветворения без признаков гемобластоза и метаплазии.
Апластические анемии могут быть наследственными и приобретенными. Последние развиваются при действии на организм некоторых химических и лекарственных веществ (бензол, бензин, пары ртути и различных кислот, красители, сульфаниламиды, антибиотики, цитостатические препараты, препараты золота, висмута, мышьяка и др.), ионизирующей радиации, при ряде инфекций (герпесвирусные инфекции, туберкулез), аутоиммунных заболеваниях (системная красная волчанка, ревматоидный артрит), эндокринопатиях (дисфункция щитовидной железы, яичников, тимуса), а также при стрессе, голодании, расстройствах пищеварения. Описаны случаи апластической анемии у жителей Хиросимы и Нагасаки, перенесших острое лучевое поражение после взрыва атомной бомбы.
Патогенез анемии до конца неизвестен. Считается, что при апластических анемиях имеет место дефицит частично детерминированных (плюрипотентных) стволовых клеток (КОЕ-ГЭММ) в результате их некроза или апоптоза при действии повреждающих факторов, потери способности к пролиферации, патологии гемопоэзиндуцирующего микроокружения (с нарушением процессов не только образования, но и созревания СКК), образования аутоантител.
Апластические анемии могут быть тотальными, протекающими с редукцией одновременно красного и белого ростков кроветворения (анемия Фанкони, анемия Эстрена-Дамешека), и парциальными, с избирательным угнетением красного ростка кроветворения (анемия Блекфена-Даймонда, парциальная красно-клеточная аплазия). Для тотальной апластической анемии характерна панцитопения (низкое содержание всех форм клеток в крови), сочетаю-
щаяся с панмиелопатией (низкое содержание всех форм клеток в костном мозгу), для парциальной - дефицит эритроидных клеток в крови и костном мозгу.
Заболевание чаще начинается постепенно, в крови отмечается снижение содержания гемоглобина (до 30-20 г/л), эритроцитов, ретикулоцитов. Анемия, как правило, нормохромная, макроцитарная. Характерно ускорение СОЭ до 30-50 мм/ч. При тотальной форме аплазии лейкопения сопровождается абсолютной нейтропенией, относительным лимфоцитозом. Содержание тромбоцитов уменьшается до (60-30)-109/л и ниже, удлиняется время кровотечения, развивается геморрагический синдром.
В костном мозгу выявляются резкое снижение количества ядросодержащих элементов, торможение созревания клеток, почти полное исчезновение мегакариоцитов. При парциальной апластической анемии гранулоцитарный и мегакариоцитарный ростки сохраняются без существенных изменений.
Среди анемий, связанных с нарушенным кровообразованием, выделяют также анемии хронических заболеваний(гипохромные) и анемии, ассоциированные с заболеваниями внутренних органов(нормохромные). При этом выраженность анемического синдрома прямо пропорциональна продолжительности и тяжести основного заболевания, признаки которого чаще превалируют над гипоксическими проявлениями анемии.
Анемия хронических заболеваний (АХЗ) развивается при инфекционно-воспалительных заболеваниях (менингит, пневмония, туберкулез, инфекционный эндокардит, остеомиелит, сифилис, ВИЧ-инфекция, грибковые инфекции и др.), системных заболеваниях соединительной ткани (ревматизм, ревматоидный артрит, системная красная волчанка, дерматомиозит и др.) и опухолях (множественная миелома, неходжкинские лимфомы, лимфогранулематоз, рак легкого, рак молочной железы, рак яичников и др.). К АХЗ не относятся анемии, возникающие при заболеваниях эндокринной системы, печени и почек (даже если они являются хроническими). В патогенезе АХЗ (рис. 14-8) основное значение имеют: нарушение метаболизма железа, недостаточная продукция эритропоэтина, угнетение эритропоэза, укорочение продолжительности жизни эритроцитов (в среднем до 80 дней). Развитие АХЗ у больных со злокачественными новообразованиями, наряду с цитокинопосредованным угнетением эритропоэза, связано также с метастатическим поражением костного мозга и миелофиброзом.
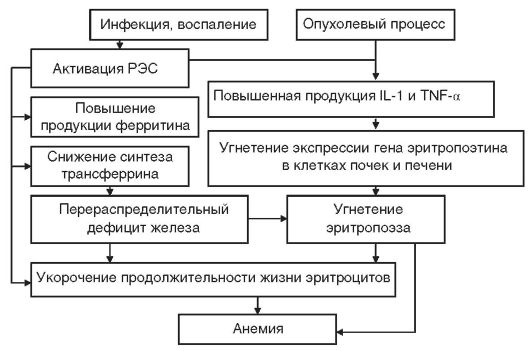 Рис. 14-8.Схема патогенеза анемии хронических заболеваний. РЭС - ретикулоэндотелиальная система
Рис. 14-8.Схема патогенеза анемии хронических заболеваний. РЭС - ретикулоэндотелиальная система
Анемии, ассоциированные с заболеваниями внутренних органов, включают анемии при эндокринных заболеваниях, заболеваниях печени и почек.
К числу анемий при эндокринных заболеванияхотносятся анемии при заболеваниях щитовидной и паращитовидных желез, надпочечников, половых желез, гипопитуитаризме и др., в основе патогенеза которых лежит депрессия эритропоэза при дефиците или, напротив, гиперсекреции ряда гормонов. В частности, такие гормоны, как тироксин, кортизол, тестостерон в очень высоких концентрациях вызывают угнетение пролиферативной активности эритроидных прекурсоров. В случае сгущения крови в результате дегидратации (при надпочечниковой недостаточности, гипотиреозе) диагностика анемии может быть затруднена.
К анемиям при заболеваниях печениотносятся анемии, возникающие при диффузных поражениях органа (циррозе, хроническом гепатите, гемохроматозе и др.). Патогенез анемии при заболеваниях печени отличается многообразием патогенетических факторов, что определяется особенностями патогенеза основного заболевания. Выделяют следующие механизмы развития анемии:
• угнетение процессов кроветворения в костном мозгу вследствие прямого токсического влияния на клетки-предшест-
венницы гемопоэза алкоголя (при алкогольном поражении печени) и эндогенных токсинов (при нарушениях обезвреживающей и клиренсной функции печени), при нарушениях метаболизма железа и депонирования витамина В12 и фолиевой кислоты в пораженной печени;
• укорочение продолжительности жизни эритроцитов в результате прямого повреждающего действия токсических продуктов экзогенного (алкоголь) и эндогенного (при эндотоксемии) происхождения, гиперспленизма, при нарушениях внутриклеточного метаболизма эритроцитов (например, в связи с дефицитом в клетках НАДФ+) и их способности к деформации (вследствие патологии клеточной мембраны при изменениях фракционного состава фосфолипидов, снижении содержания сиаловых кислот);
• кровотечения из расширенных вен желудочно-кишечного тракта (при циррозе печени), носовые, геморроидальные и иной локализации (при формирующейся недостаточности синтеза факторов свертывания крови вследствие нарушений белкового обмена).
В подавляющем большинстве случаев при заболеваниях печени регистрируется нормохромная нормоцитарная анемия, при присоединяющемся дефиците железа - микроцитарная нормоили гипохромная, при недостаточности витамина В12 и фолиевой кислоты, метастазах рака желудка в печень - макроцитарная анемия нормоили гиперхромного типа.
Анемия при заболеваниях почекможет выявляться у больных острым гломерулонефритом, интерстициальным нефритом, хронической почечной недостаточностью. Патогенез анемии при заболеваниях почек определяется снижением продукции эритропоэтина клетками юкстагломерулярного аппарата, депрессией кроветворения в костном мозгу (в результате нарушения пролиферативной активности эритроидных клеток, торможения процессов синтеза гема) и сокращением срока жизни эритроцитов (до 40-50 дней) при действии токсических продуктов азотистого обмена.
Дата добавления: 2016-07-11; просмотров: 5078;











