Кинетика разветвленных цепных реакций
К таким реакциям относятся реакции окисления молекулярным кислородом H2, P, PH3, SiH4, CS2, CO.
Рассмотрим ее на примере окисления H2.
При небольших давлениях (несколько десятков мм. рт. ст.) схема реакции:
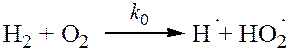
| (зарождение W0) |
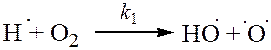
| (разветвление) |
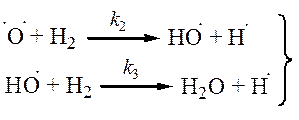
| (продолжение) |
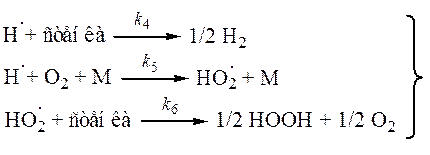
| (обрыв) |
Радикал HO2· при малых давлениях и температурах неактивен в продолжении цепей, поэтому реакция (5) – обрыв цепей. Тогда реакцию (6) можно исключить из рассмотрения.
[·O·] и [·OH] << [H·], поэтому обрыв с участием этих частиц принебрежим по сравнению с реакциями (4) и (5).
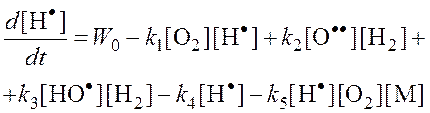
| (1) |
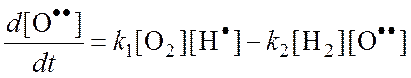
| (2) |
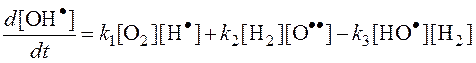
| (3) |
H.H. Семенов предложил метод полустационарных концентраций, по которому в нестационарных условиях можно считать концентрации всех активных центров стационарными, кроме одного, концентрация которого намного больше остальных.
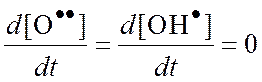 ;
; 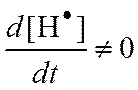
Из (3):
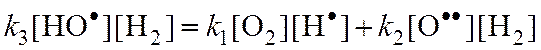
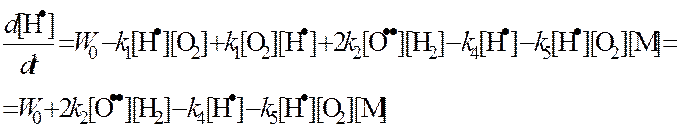
Из (2):
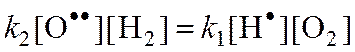
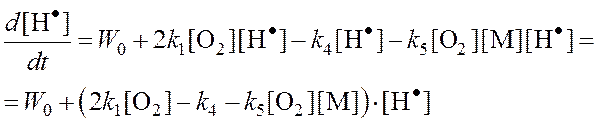
Обозначим:
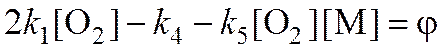 , тогда
, тогда
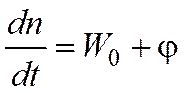
|
j – разность удельных скоростей разветвления и обрыва цепей (эффективных констант разветвления и обрыва).
j = f – g - фактор автоускорения.
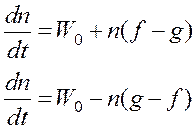
Если g > f, т.е. j < 0, то в системе устанавливается стационарная концентрация радикалов.
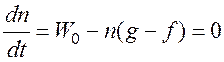 ;
; 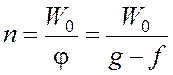 .
.
Наличие разветвления лишь несколько увеличивает стационарную концентрацию радикалов по сравнению с f = 0.
Если f > g, т.е. j > 0, то, интегрируя уравнение 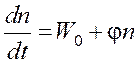 ,
,
получаем. 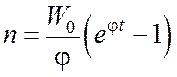
В этом случае имеет место прогрессивное нарастание концентрации свободных радикалов, и, следовательно, и скорости процесса: через каждые 1/j секунд скорость реакции возрастает в «e» раз. Таким образом, через несколько интервалов 1/j практически полное отсутствие реакции сменяется взрывным протеканием процесса, т.е. вслед за периодом индукции следует цепное воспламенение.
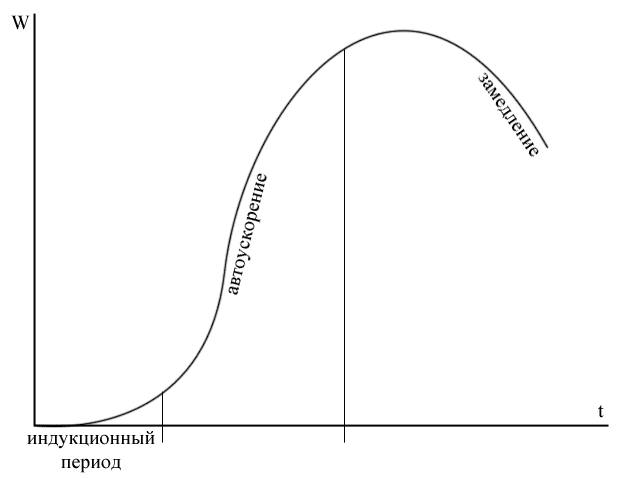
Естественно, что при цепном воспламенении кинетику нельзя считать стационарной, но по методу Н.Н. Семенова удается проводить расчеты при 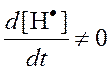 .
.
Дата добавления: 2020-07-18; просмотров: 616;











