Гормональная регуляция роста
Кроме воды и минеральных веществ, поступаемых из почвы, и углеводов, образующихся в процессе фотосинтеза, которые необходимы в качестве источника энергии и строительных белков протоплазмы, растительная клетка для оптимального роста требует еще и некоторые другие химические соединения. К ним, в частности, относятся органические соединения, которые называются гормонами. Потребность в количестве гормонов обычно очень малая, и в большинстве случаев, гормоны синтезируются в достаточных количествах самим растением.
Любой гормон представляет собой вещество, образуемое в малых количествах в одной части организма и транспортируемые затем в другую часть растения, где он оказывает соответствующее действие. Расстояние, на которое транспортируется гормон, может быть относительно большим, например от корня до листа, от последнего к почке, может быть и меньшим – от апикальной меристемы до находящихся ниже клеток, или совсем малым – в пределах одной клетки.
У высших растений содержатся несколько важных классов регулирующих рост гормонов, основными из которых являются: ауксин, гиббереллины, цитокинины, абсцизовая кислота и этилен.
Ауксин. В 30-х гг. ХХ столетия Ф. Венту удалось подтвердить мысль Ч. Дарвина, что в верхушках колеоптилей злаков действительно образуется значительное количество способного к диффузии вещества, которое контролирует рост нижележащих зон. Это вещество назвали ауксином (от греческого слова auxein – расти). Большой вклад в изучение механизма действия ауксина внес Н. Г. Холодный.
Ауксин синтезируется растущими апикальными зонами стеблей, в том числе молодыми листьями. От апекса ауксин мигрирует в зону растяжения, где он специфически влияет на рост растяжением.
Было установлено, что природный ауксин представляет собой простое соединение – индолил-3-уксусную кислоту (ИУК):
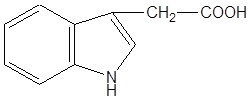
|
которая синтезируется в растениях путем ферментативного превращения аминокислоты – триптофана. Триптофан образуется из шикимовой кислоты через ряд реакций:
Шикимовая кислота → индол → серин → L-триптофан
Сам синтез ИУК из триптофана довольно сложный процесс и имеет свои особенности в отдельных растениях (рис. 6.2). Образованная из триптофана ИУК, проходит дальнейшее превращение в растениях: обратимое связывание ИУК в неактивные комплексы с белками, аминокислотами, углеводами; необратимое окисление молекулы ИУК под воздействием ферментов типа ауксиноксидазы.
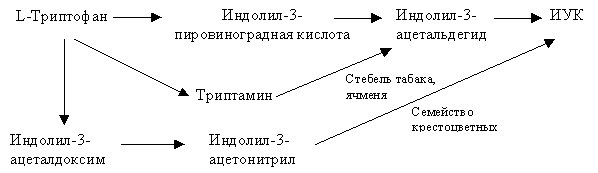
|
| Рис. 6.2. Биосинтез индолил-3-уксусной кислоты |
Транспорт ИУК происходит полярно со скоростью 10–15 мм/ч от вершины побегов к корням. Механизм полярного транспорта следующий: в апикальный конец клетки ИУК проникает пассивно совместно с Н+, а в базальном конце активно секретируется через клеточную мембрану.
Физиологическое действие ауксина сложное. Разные ткани отвечают на действие ауксина увеличением роста, которое обусловлено стимуляцией растяжения клеток (рис. 6.3).

Роль ауксина в стимуляции опадания листьев и цветов связана с заметным понижением его содержания в листьях. Это приводит к старению листьев. Стареющие ткани продуцируют этилен, который действует на отделительную зону (зона опадания).
Сам же ауксин задерживает опадание листа и цветов. Имеются доказательства, что ауксин, кроме участия в растяжении и опадании листьев, принимает также участие в процессах клеточного деления. Вероятно, ауксины стимулируют камбиальную активность. Считают, что ИУК участвует в дифференциации сосудистой ткани в период начала ростового процесса. Ауксин, вероятно, принимает участие в образовании боковых корней. Превращение завязи в плод – это еще один контролируемый ауксином процесс.
Первостепенную роль играет ауксин в ростовых движениях – тропизмах и настиях (теория гормональной регуляции тропизмов Холодного – Вента).
В основе действия ауксинов, как считают, существуют два механизма:
– быстрое влияние ауксинов на мембранную систему, где за счет энергии АТФ увеличивается транспорт водородных ионов из цитоплазмы в клеточную оболочку и ускоряется размягчение клеточной оболочки;
– относительно медленное влияние ауксинов через геномную систему на синтез белков, определяемых рост клеток.
Наличие обоих механизмов весьма вероятно, поскольку ауксин не только вызывает экскрецию протонов, но и изменяет микроструктуру цитоплазмы (микротрубочки).
Гиббереллины. Японский исследователь Е. Курасава в 1926 г. установил, что если питательную (культуральную) жидкость, на которой рос гриб гибберелла, нанести на проростки риса, то начинается активное растяжение стебля. По названию гриба выделенное из среды вещество было названо гибберелловой кислотой. Так был выделен почти одновременно с ауксином еще один класс гормонов – гиббереллинов.
В 1954 г. англичанин П. Кросс идентифицировал их структуру. Гиббереллины поздней были выделены из высших растений из неспелых семян:
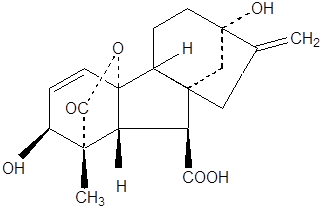
|
Гиббереллины – фитогормоны, преимущественно класса тетрациклических дитерпиноидов. Все гиббереллины – карбоновые кислоты, поэтому их называют гибберелловыми кислотами. В настоящее время известно более 110 разных гиббереллинов (ГК), многие из которых не обладают физиологической активностью в растениях.
Биосинтетическим предшественником гиббереллинов служит энт-каурен. Гиббереллины классифицируются по числу углеродных атомов на С19- и С20-гиббереллины.
Биологическая активность ГК возникает только на последнем этапе биосинтеза. Предшественники ГК гормональной активностью не обладают. ГК в растениях подвергаются гликозидированию и связыванию с белками. В общем виде синтез ГК представлен на рис. 6.4.
Мевалонат → Гераниол → Гераниол-пирофосфат → каурен →
→ кауренол → кауреновая кислота → С20- и С19-гиббереллины
Рис. 6.4. Схема синтеза гиббереллинов
ГК синтезируются главным образом в корнях и листьях. Транспорт их осуществляется пассивно с ксилемным и флоэмным током.
ГК при нанесении на некоторые растения вызывают очень сильное удлинение стебля, а в ряде случаев и уменьшение листовой поверхности. Самое яркое проявление их действия – быстрая стимуляция удлинения цветоножки (стрелкование) и во многих случаях стимуляция цветения длиннодневных растений. У короткодневных растений ГК, вероятно, оказывают обратный эффект на цветение. Место действия ГК – апикальная и интерколярная меристемы.
Обработка ГК выводит семена и клубни некоторых растений из состояния покоя. Экзогенно введенный ГК снимает у двухгодичных растений необходимость в яровизации, стратификации у тех семян, для которых стратификация необходима. На айлероновых слоях эндоспермы зерновок ячменя показано, что под воздействием ГК индуцируется синтез матричных РНК, которые кодируют образование α-амилазы и других гидролаз, а также ГА влияет на синтез мембран ЭР.
ГК вызывают партенокарпию: для этого цветки необходимо опрыскивать раствором ГК. Ауксин тоже может вызывать партенокарпию, но ГК более активны. В тканях, обработанных ГК, как правило, увеличивается содержание ИУК. Схема основных физиологических функций гиббереллинов выглядит следующим образом (рис. 6.5).
 |
Считают, что физиологической основой карликовости большинства растений является нарушение гиббереллового обмена, который приводит к недостатку эндогенных гиббереллинов.
Ауксины и гиббереллины представляют два сильно действующих класса регуляторов. Однако они не способны регулировать ход ростового процесса в онтогенезе. Ни один из них не способен повлиять на процесс зеленения изолированных листьев, закладку почек в культуре тканей.
Этими свойствами обладают цитокинины, получившие свое название из-за способности стимулировать цитокинез (клеточное деление). Учение о цитокининах начинается с открытия полуискусственного продукта – кинетина
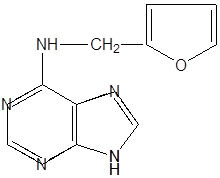
|
который образуется из ДНК при кислотном гидролизе. Природный цитокинин был идентифицирован как зеатин
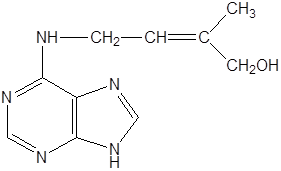
|
и получен он из неспелых зерновок кукурузы в начале семидесятых годов ХХ в.
В настоящее время цитокинин обнаружен в некоторых бактериях, водорослях, грибах и насекомых.
Сегодня так суммируют представления о биосинтезе цитокининов (рис. 6.6).
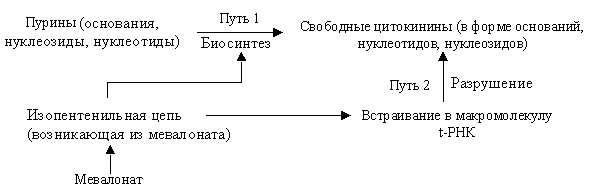
|
| Рис. 6.6. Схема синтеза цитокининов |
По существующим данным в бактериях осуществляется только путь 2, а у растений – оба пути.
Основное место синтеза цитокининов – корни; однако в последнее время получены данные о том, что синтез цитокининов может происходить и в семенах (семена гороха).
Из корней цитокинины пассивно транспортируются в наземные органы по ксилеме.
Известно множество физиологических эффектов цитокининов, из которых наиболее значимы (рис. 6.7):
– стимуляция клеточного деления и дифференциации;
– задержка процессов старения.

Роль цитокининов в процессах клеточных делений связана со стимуляцией репликации ДНК и регуляцией переходов из предшествующих фаз в фазу митоза. Имеются данные о действии цитокинина на транспорт K+, Н+, Са2+.
Этилен(СН2=СН) – гормон старения (гормональный фактор газоподобного типа). Давно известно, что одно гнилое яблоко в бочке вызывает порчу всех остальных. Как оказалось, в гнилом яблоке вырабатывается летучее вещество – этилен, вызывающее разрушительное действие в здоровых плодах.
Впервые физиологический эффект этилена на растения был описан Д. А. Нелюбовым в 1901 г. Он выявил, что в этиолированных проростках (гороха) этилен вызывает тройную реакцию стебля: ингибирование растяжения, утолщение и горизонтальную ориентацию. В 20-х гг. было показано, что этилен способен ускорять спелость плодов и регулировать процесс старения у растений. Тот факт, что действие этилена можно снять повышенной концентрацией СО2 в окружающей среде, лежит в основе практического приема хранения яблок и других плодов. Этилен вызывает образование апикального изгиба во многих этиолированных проростках; действие света на выпрямление изгиба связано с тем, что свет ингибирует образование этилена. Этилен может также влиять на геотропизм и другие опосредованные ауксином реакции (например, подавление роста боковых почек).
Этилен тормозит полярный транспорт ауксина, усиливает процессы старения, опадения листьев и плодов, устраняет апикальное доминирование, а также ускоряет поспевание плодов (рис. 6.8).

Образуется этилен из серосодержащей аминокислоты метионина, который превращается в S-аденозилметионин. Затем с помощью фермента АЦК-синтазы синтезируются 1-амино-циклопропан-1-карбоновая кислота (АЦК) и 5/-метилтиоаденазин. Последний этап синтеза этилена происходит в присутствии кислорода и катализируется ферментом АЦК-оксидазой. Постоянное пополнение L-метионина происходит в результате превращения 5/-метилтиоаденазина через последовательное образование 5/-метилтиорибозы, 5/-метилрибозо-1-фосфат и α-кето-γ-метилтиомасляной кислоты (цикл Янга) (рис.6.9).
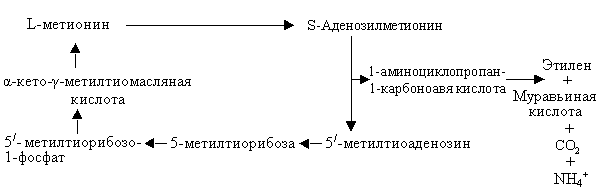
|
| Рис. 6.9. Схема биосинтеза этилена |
Абсцизовая кислота (АБК) – природный гормональный ингибитор роста терпеноидной природы.
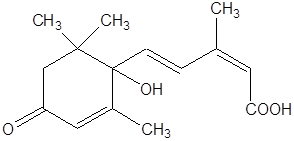
|
Название АБК получила в связи с ее способностью вызывать опадение черешков, листьев, завязей и плодов (от английского abscission – отнятие, ампутация).
В 1955 г. из старых листьев фасоли и некоторых древесных растений выделили вещества, которые ускоряли опадение листьев. Была высказана догадка, что опадение листьев регулируется не только эндогенными ауксинам и этиленам, но и другими веществами, которые образуются в спелых листьях. Скоро (1961 г.) подобное вещество было найдено и в молодых плодах хлопчатника. Последующие исследования показали, что веществом, ускоряющим опадение, во всех случаях была АБК. Это соединение стимулировало опадение листьев у березы, клена и др.
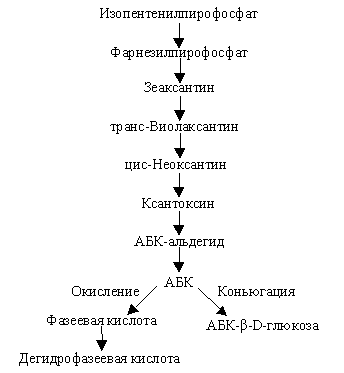
|
| Рис. 6.10. Схема синтеза и метаболического превращения абсцизовой кислоты |
Молекулярная структура АБК была установлена в 1963 г. На основе ее структуры сделано предположение, что ее синтез, как и синтез гиббереллинов, идет по пути образования изопреноидов. Изопентенилпирофосфат является тем структурным элементом, из которого образуется АБК. Пути биосинтеза, распада и связывания АБК, выявленные с помощью мутантов, выглядят следующим образом (рис. 6.10).
Катаболизм АБК идет по пути коньюгации и образования глюкозидов, а также по пути деградации с образованием соответствующих кислот (фазеевой, оксиабсцизовой и др. кислот).
АБК синтезируется главным образом в листьях, а также в корневом чехлике. Перемещение АБК в растениях наблюдается как в базипетальном, так и в акропетальном направлениях в составе ксилемного и флоэмного соков.
 |
Как мы уже в начале отметили, в большинстве случаев, АБК тормозит рост растений. Этот гормон в ряде случаев выступает как антагонист ИУК, цитокинина и гиббереллинов. АБК ингибирует прорастание семян и рост почек, содействует опадению листьев, которое связано с их старением. АБК ускоряет распад нуклеиновых кислот, белков и хлорофилла. В некоторых случаях АБК является активатором: она стимулирует развитие партенокарпии у розы, удлинение гипокотеля огурца, образование корней у черенков фасоли (рис. 6.11).
В высоких количествах АБК образуется при стрессах (при действии разных неблагоприятных факторов внешней среды). Особенно много ее образуется при водном стрессе в листьях. В этих случаях она вызывает отток ионов K+ из замыкающих клеток, в результате чего устьица закрывается и тем самым предотвращается опасность высыхания. Действие АБК в этом случае обусловлено ее влияние на функционирование Н+-помпы. АБК может выполнять и сигнальную роль при водном диффеците .
Таким образом, АБК является ингибитором широкого действия, который влияет на процессы покоя, роста, движения устьиц, геотропизма, поступления веществ в клетку. АБК участвует в стрессовых реакциях растений.
К группе фитогормонов относят жасмоновую и салициловую кислоты, а также обнаруженные в растениях, в последние годы, другие гормональные соединения.
Фузикокцин. В 70-е годы Г. Муровцев (СССР) и другие показали, что к природным регуляторам роста следует отнести и фузикокцин. Фузикокцин был открыт в 1964 г. Баллио (Италия) как токсин, выделяемый патогенным грибом Phusicoccum amygdale. Фузикокцин широко распространен в природе. Сейчас известно более 15 соединений этой группы. Кроме грибов, они содержится в клетках водорослей, высших растений (моховидные, папоротникообразные, цветковые) и даже животных.
По химической природе фузикокцин относится к терпеноидам и у цветковых растений представляет собой дитерпен – С36 Н56 О12. В клетках высших растений его содержится 10-5 – 10-8 г/кг сырой массы.
По своему действию фузикокцин похож на ауксин. Он стимулирует растяжение клеток корней, стеблей, колеоптилей, листьев, причем даже активнее, чем ИУК, а также прорастание семян (например, пшеницы). Фузикокцин вызывает открывание устьиц в присутствии и отсутствии света (антагонист АБК). Это связано с активацией протонной АТФ-азы и калиевых каналов. Кроме того, фузикокцин стимулирует транспорт кальция, хлора, глюкозы, аминокислот в клетку, а также дыхание и корнеобразование.
Фузикокцин обладает антистрессовыми функциями. Он повышает всхожесть семян при повышенных и пониженных температурах, избыточном увлажнении, при засолении. Замачивание семян в растворе фузикокцина, а также опрыскивание им в фазу кущения озимых пшеницы, ржи и ячменя повышает их морозоустойчивость благодаря лучшему развитию фотосинтетического аппарата у обработанных растений и накоплению ими большего количества в клетках сахаров. Фузикокцин защищает растения риса при засолении, повышает устойчивость клубней картофеля к некоторым заболеваниям.
Жасмоновая кислота(ЖК) и ее метиловый эфир

|
Могут контролировать такие процессы как созревание плодов и рост корня, изгиб усиков производство жизнеспособной пыльцы, устойчивость растений к насекомым и патогенам. Жасмоновая кислота и ее метиловый эфир могут синтезироваться при механическом повреждении из линоленовой кислоты, образующейся при распаде фосфолипидов клеточных мембран. Жасмоновая кислота транспортируется в неповрежденные участки по флоэме, а ее метиловый эфир как летучее соединение – по воздуху.
Содержание ЖК в тканях растений возрастает при механических раздражениях: изменение тургорного давления при водном дефиците, движении усиков, взаимодействии корневых волосков с частицами почвы. Синтез ЖК активируется элиситорами и системином. Активация синтеза ЖК в ответ на ряд механических раздражений происходит с участием Са-кальмодулинового пути сигнальной трансдукции. Концентрация ЖК наиболее высока в зонах клеточного деления, молодых почках, цветках, тканях околоплодника, в гипокотельном крючке бобовых растений. ЖК приводит к снижению содержания хлорофилла и хлорозу.
Концентрация жасмоновой кислоты в растительных тканях резко возрастает при механическом повреждении или воздействии элиситоров, способных индуцировать реакцию сверхчувствительности. Последняя является одним из самых эффективных способов защиты растительных организмов от повреждения, поскольку происходит быстрая локальная гибель инифицированных растительных клеток вместе с патогеном, что, в конечном счете, обеспечивает устойчивость всего растения. Синтез жасмонатов запускается при поранении растения, например, в процессе поедания фитофагами.
Жасмоновая кислота активирует экспрессию ряда генов, продукты которых вырабатываются в ответ на такие стрессовые воздействия, как механическое повреждение тканей и заражение патогенами. К их числу относятся, например, тионины, экстенсины, ферменты, участвующие в синтезе ряда фенольных соединений и фитоалексинов. Поэтому обработка растений жасмоновой кислотой резко повышает их устойчивость к повреждениям. Жасмоновая кислота – один из факторов индукции иммунитета растений к повторным заражениям.
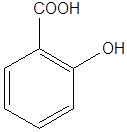 |
Салициловая кислота(СК):
также обеспечивает растению устойчивость к повреждениям, вызываемыми различными патогенами. Синтез СК играет определяющую роль в реакции сверхчувствительности, а также в пролонгированной системной устойчивости растений к широкому кругу инфекций.
Синтез СК начинается в растениях с превращения фенилаланина в транс-коричную кислоту (рис. 6.12):
Фенилаланин → транс-Коричная кислота → Бензойная кислота →
→ Салициловая кислота
Рис. 6.12. Схемабиосинтеза салициловой кислоты
Образование салициловой кислоты происходит с участием фермента 2-гидроксилазы бензойной кислоты. Фермент представляет собой цитохром-Р450-монооксигеназу, использующую молекулярный кислород для гидроксилирования бензойной кислоты.
Салициловая кислота может образовывать метиловый эфир и (или) связываться с глюкозой под действием глюкозилтрансферазы.
Образование больших количеств пероксида водорода является также причиной активации синтеза фитогормонов – салициловой и жасминовой кислот. Повышение содержания салициловой кислоты усиливает реакцию СВЧ, поскольку салицилат является ингибитором каталазы – фермента, расщепляющего пероксид водорода. То есть пероксид водорода, активируя синтез салициловой кислоты, способствует еще большему накоплению активных форм кислорода и таким образом вызывает усиление СВЧ-реакции. По мере затухания реакции СВЧ салициловая кислота переводится в связанную форму, взаимодействуя с глюкозой и образуя гликозиды. Следует отметить, что синтез салициловой кислоты и образование ее коньюгантов – ключевые элементы не только в СВЧ-реакции, но и в формировании системного приобретенного иммунитета растения. Таким образом, в ходе СВЧ-реакции в растении происходит также формирование иммунитета к повторным заражениям.
Системин– полипептидный гормон, обнаруженный в растениях недавно (1991 г.), состоит из 18 аминокислот. Как и большинство пептидных гормонов животных, он образуется из своего предшественника – просистемина, молекула которого содержит 200 аминокислотных остатков. Впервые системин был выделен из листьев молодых растений томатов, затем его обнаружили в картофеле, перце и некоторых других растениях. По строению молекулы системинов из разных видов растений отличаются, но функционируют одинаково. Системин проявляет биологическую активность в низких концентрациях – 10–15 М.
В 1999 г. был идентифицирован рецептор системина, представляющий собой высокомолекулярный полипептид с молекулярной массой 160 кДа и локализованный в плазмалемме. В отличие от ранее известных гормонов он запускает системы, защищающие растения от патогенов, повышает устойчивость к заболеваниям.
|
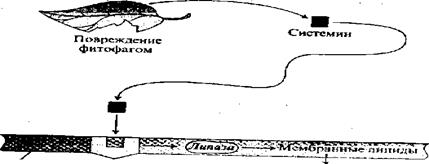
Важным компонентом защитных реакций растений являются ингибиторы ферментов, участвующие в процессах переваривания пищи насекомыми. Наиболее изученными из них являются ингибиторы протеолитических ферментов (протеазы), которые расщепляют белки в процессе пищеварения. У насекомых, которые питаются растениями, содержащими ингибиторы протеаз, резко падают темпы роста и развития, поскольку в их меню отсутствуют свободные аминокислоты. Ингибиторы протеаз обычно появляются в растениях в ответ на повреждение. Экспрессия генов, кодирующих ингибиторы протеаз, индуцируется механическим повреждением растений и непосредственно контролируется двумя фитогормонами: небольшим пептидом из 18 аминокислот системином и упоминавшейся жасмоновой кислотой.
Показано, что синтез ингибиторов протеаз является результатом целого ряда событий (рис. 6.13). На первом этапе повреждения растения насекомыми синтезируется системин – первый гормон пептидной природы, обнаруженный в растениях. Затем системин транспортируется по флоэме в неповрежденные участки растения, где взаимодействует с рецепторами и инициирует синтез еще одного гормона — жасмоновой кислоты, которая, в свою очередь, активирует экспрессию генов, кодирующих синтез ингибиторов протеаз. Установлено, что у томатов системин включает в системную регуляцию более 20 генов, участвующих в повышении устойчивости к повреждению фитофагами, патогенами, поранению, а также к ряду абиотических стрессовых воздействий. При этом регуляция экспрессии некоторых «защитных» генов системином может осуществляться вместе с другими гормонами, например, такими, как АБК, этилен, жасмоновая кислота.
В настоящее время в растениях выявлены и другие гормоны, в частности фитосульфокины, участвующие в регуляции клеточных делений и других ростовых процессов у растений. Это небольшие пептиды, состоящие из 4–5 аминокислот.
Из томатов, табака и конских бобов выделен еще один гормональный полипептид, содержащий 50 аминокислотных остатков и обеспечивающий быстрое подщелачивание среды, в которой находятся клетки. Он получил название фактора быстрого подщелачивания (ФБП). Другие его функции неизвестны.
В клетках арабидопсиса обнаружен полипептид, кодируемый геном CLAVATAS, и играющий важную роль в делениях клеток и дифференцировке цветочных меристем.
Олигосахарины.В регуляции физиологических процессов у растений участвуют короткие углеводы – олигосахариды. В 1980 г. было обнаружено, что продукты деградации клеточной стенки Phytophtora вызывают специфичную иммунную реакцию. Небольшие перестройки углеводного скелета приводили к исчезновению эффекта, поскольку большинство олигосахаридов не проявляют активности. Олигосахариды, вызывающие физиологический эффект, назвали олигосахаринами.
Олигосахарины образуются в результате расщепления полисахаридов клеточной стенки. Расщепление вызывают как собственные ферменты, так и ферменты грибов и бактерий. В состав олигосахаринов могут входить ксилоза, рамноза, галактоза и остатки уроновых кислот. Из гликолипидов, входящих в состав мембран, образуются олигосахарины, содержащие инозитол.
Установлено, что олигосахариды суспензионной культуры клена остролистного стимулируют деление клеток в культуре in vitro. Это доказывает присутствие в экстрактах олигосахаринов.
При действии ферментов, разрушающих гликаны клеточной стенки, получают активные олигосахарины, стимулирующие созревание плодов. Специфические олигосахарины являются сигналами при узнавании симбионтов в системе Rhizobium – растение-хозяин. Без обмена олигосахаринами клубеньки у бобовых не образуются.
В последние годы к регуляторам роста, проявляющим гормональную активность в растениях, стали относить брассиностероиды и простагландины (БС).
Брассиностероиды. В середине 60–70 гг. ХХ столетия были получены данные о том, что вместе с известными фитогормонами имеются вещества, которые также обладают регуляторными качествами. В 1970 г. П. Митчеллом с сотрудниками из пыльцы рапса и ольхи была выделена липидная фракция, которая стимулировала рост растений. Эта группа соединений была названа брассинами или брассиностероидами. Молекулярное строение нового регулятора роста – брассинолида была выявлена тогда, когда из 40 г пыльцы рапса выделили 4 г кристаллического вещества – С28Н48О6.

|
Термин брассинолид, который давал название всему классу фитогормонов, соответствовал названию рапса – Brassica napus. В соответствии с источником выделения были даны названия и некоторым другим представителям брассиностероидов, которые выделили позже: катастерон, долихолид, теостерон и т. д.
Брассиностероиды обладают полифункциональным действием, которое проявляется во взаимодействии со всеми фитогормонами. Они повышают устойчивость растений к засухе, холоду, высшим температурам, излишней влажности и т. д.
Брассиностероиды найдены среди растений разных таксономических групп. Анализ литературных данных говорит о том, что БС присутствуют во многих органах и тканях растений, однако, в большинстве случаев не могут быть еще идентифицированы из-за малой чувствительности методов.
Весьма многочислено действие БС на физиолого-биохимические функции растений (рис. 6.14).
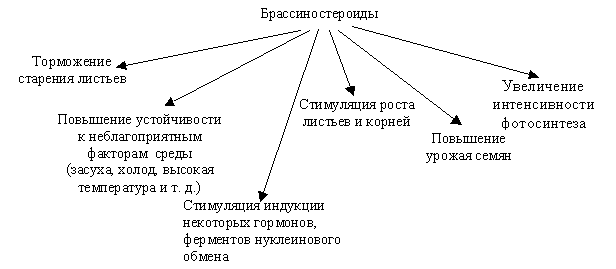
|
| Рис. 6.14. Схема основных функций брассиностероидов в растениях |
БС влияют (стимулируют) рост листьев и корней, проростков. Отмечена стимуляция, как растяжения, так и деления клеток; БС увеличивают размеры органов и урожай семян, увеличивают интенсивность фотосинтеза, тормозят старение листьев. Одной из самых интересных особенностей БС является способность стимулировать индукцию ауксина, этилена, а также ряда ключевых ферментов нуклеинового обмена растений: ДНК – полимеразы, рибонуклеазы, а также АТФазы. Во всех тестах для ГК БС проявляют активность в концентрациях на один и более порядков ниже. БС являются синергистами ауксинов, гиббереллинов, цитокининов и этилена.
Простагландины (ПГ)– вещества липидной природы, обладающие большим спектром биологического действия в организме животных, в которых они являются гормонами.
В последнее время появляется все больше экспериментальных фактов о присутствии ПГ в растениях и их регуляторной роли.
Простагландины – это производные полинасыщенных гидроксилированных жирных кислот, которые состоят из 20 углеродных атомов. Для всех соединений характерно наличие циклопентанового кольца, двух боковых цепей, двойной (транс) связи при С13 и гидроксила в положении 15. Этот гидроксил имеет большое значение в определении биологической активности ПГ.
В зависимости от строения пентанового кольца все ПГ делятся на 4 группы: А, Б, Е и F; индекс при соответствующей букве означает количество двойных связей в боковых цепях. Во всех природных ПГ ОН-группа у 15 атома углерода находится в α-положении; β-изомеры в природе не встречаются.
Наибольший интерес имеют ПГ группы Е (ПГЕ); они характеризуются большим спектром биологического действия и, как правило, обладают наибольшей активностью.
Структура наиболее активного простагландина ПГЕ2 имеет вид:

|
В начале 70-х годов прошлого века в растениях обнаружен предшественник ПГ-арахидоновая кислота. Непосредственно ПГ группы А обнаружены в луке Allium cepa. В последние годы идентифицированы ПГ (Е1, Е2 и др.) в тканях ряда высших растений.
Общую схему биосинтеза ПГ в растениях можно представить следующим образом:
 |
Физиолого-биохимические процессы, на которые влияют простагландины, включают цветение, интенсивность фотосинтеза, галообразование в клубнях, фитофтороустойчивость картофеля, поведение устьиц, рост гипокотелей салата, прорастание семян, активность кислой фосфотазы, величина листовой поверхности, проницаемость мембран.
Учитывая возможную роль ПГ в растениях, изучалась их биологическая активность на тестах, которые используются при определении активности фитогормонов – растяжение колеоптилей, рост корешков, прорастание семян и т. д. Однако, пока нет единого взгляда на гормональную активность ПГ в растениях. Можно только отметить, что ПГ выполняет ряд важных функций в регуляции метаболическими процессами в растительной клетке.
Дата добавления: 2016-07-11; просмотров: 4606;











