Работа 1. Получение коллоидных растворов методом конденсации и изучение их оптических свойств
Цель работы: научиться получать коллоидные растворы методом конденсации и изучить оптические свойства коллоидных растворов.
Реактивы и приборы:аппарат Тиндаля, штатив с пробирками, 0,01н растворы KI, AgNO3, H2SO4, Na2S2O3, K4[Fe(CN)6], CuSO4, раствор канифоли в спирте, вода.
Задание 1.Получить коллоидные растворы методами физической и химической конденсации (для золей, полученных методом химической конденсации, написать схемы строения мицелл).
Опыт I. Получение золя иодида серебра.
В пробирку на 1/2 налить раствор KI и прилить к нему по каплям при встряхивании раствор AgNO3 до появления опалесцирующего золя AgI (легкой светящейся мути):
KI + AgNO3 ® AgI¯ + KNO3
Опыт II. Получение золя серы.
К раствору Na2S2O3 (1/2 пробирки) прилить 4 – 5 капель раствора H2SO4. При стоянии полученного растворамедленно образуется опалесцирующий золь серы:
Na2S2O3 + H2SO4 ® S¯ + Na2SO4 + SO2 + H2O
Опыт III. Получение золя гексацианоферрата (II) меди.
К раствору K4[Fe(CN)6] (1/2 пробирки) прилить по каплям при встряхивании раствор CuSO4 до образования золя красно-кирпичного цвета:
K4[Fe(CN)6] + 2CuSO4 = Cu2[Fe(CN)6]¯ + 2K2SO4
Опыт IV. Получение золя канифоли методом замены растворителя.
К воде (1/2 пробирки) добавить 1–2 капли спиртового раствора канифоли и энергично встряхнуть пробирку. Образуется молочно-белый золь, так как канифоль в воде нерастворима.
Сделать вывод о методах получения золя в опытах I – III и в опыте IV.
Задание 2.Изучить оптические свойства полученных коллоидных растворов.
Приготовленную пробирку с водой или раствором электролита, например KI, а также пробирки с полученными коллоидными растворами по очереди поместите через верхнее отверстие в черный ящик, где находится источник света (упрощенный, без фокусирующей линзы, аппарат Тиндаля). Если в пробирке коллоидный раствор, то через боковое отверстие должна наблюдаться яркая светящаяся полоса (конус Тиндаля). Полученные результаты оформите в виде следующей таблицы.
| Система | Метод получения и тип реакции | Внешний вид золя (цвет, опалесценция) | Наличие конуса Тиндаля | Вывод |
| Раствор электролита | ||||
| Золь иодида серебра | ||||
| Золь серы | ||||
| Золь гексацианоферрата меди | ||||
| Золь канифоли |
На основании изучения оптических свойств полученных растворов сделайте вывод, являются ли они коллоидными и почему.
Работа 2. Изучение коагулирующего действия электролитов на золь и определение знака заряда частиц золя. Проверка защитных свойств желатина.
Цель работы: научиться экспериментально определять пороги коагуляции для электролитов по отношению к данному золю, а также знак заряда частиц золя по значениям порогов коагуляции; экспериментально подтвердить, что растворы белка (желатина) повышают порог коагуляции, т.е. обладают защитным действием.
Реактивы и приборы: золь гидроксида железа, 0,7М раствор KCl, 0,01М раствор K2SO4, 0,001М раствор К3РО4, 0,1% раствор желатина, колбы для титрования, бюретки, пипетки Мора на 10 мл.
Задание 1.Определить пороги коагуляции для данных электролитов по отношению к золю гидроксида железа (III)
В три колбы для титрования (по одной для каждого электролита) перенесите пипеткой Мора по 10 мл раствора золя гидроксида железа (III). Каждую колбу с раствором золя оттитруйте соответственно растворами электролитов KCl, K2SO4, K3PO4 до появления мути или посветления окраски раствора. Муть заметна при сравнении с исходным золем и должна быть одинакова во всех трех колбах.
Рассчитайте порог коагуляции g для каждого электролита по формуле:
g= 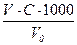
где C – концентрация электролита, моль/л; V – объем раствора электролита, мл; V0 – объем раствора золя, мл; g – порог коагуляции, ммоль/л.
Данные опыта и результаты расчетов оформите в виде следующей таблицы.
| Номер опыта | Раствор электролита для титрования | Объем золя, мл | Концентрация электролита, моль/л | Объем электролита, мл | Порог коагуляции, ммоль/л |
| KCl | 0,7 | ||||
| K2SO4 | 0,01 | ||||
| K3PO4 | 0,001 |
Задание 2.Определить знак заряда частиц золя гидроксида железа (III) по значениям порогов коагуляции.
Найдите соотношения порогов коагуляции заданными электролитами, которые получены в задании 1:
g1 : g2 : g3 =
На основании полученных данных сделайте вывод о знаке заряда иона-коагулянта, а также укажите знак заряда частиц золя гидроксида железа (III).
Задание 3.Проверить защитные свойства желатина
В колбу внесите пипеткой Мора 10 мл раствора золя и 0,5 мл 0,1% раствора желатина. Оттитруйте полученный раствор раствором KCl, сравнивая степень мутности с таким же раствором в задание 1. Рассчитайте порог коагуляции раствора KCl по отношению к золю гидроксида железа после добавления желатина (gж) и определите, во сколько раз увеличился порог коагуляции золя после добавления желатина: gж / g1 =
На основании изменения порога коагуляции при добавлении желатина сделайте вывод о защитных свойствах желатина и объясните механизм его защитного действия.
Работа 3.Электрофорез аминокислот на бумаге
Цель работы: разделить смесь аминокислот методом электрофореза на бумаге; на основании электрофореграммы определить знак заряда аминокислот в данной среде.
Реактивы и приборы: прибор для электрофореза аминокислот, полоски хроматографической бумаги типа FN–15, буферный раствор с рН = 9,24, растворы аспарагиновой кислоты и аргинина, красящий раствор Баролье, сушильный шкаф.
 Порядок выполнения работы предусматривает несколько этапов ее.
Порядок выполнения работы предусматривает несколько этапов ее.
1. На середине полоски хроматографической бумаги простым карандашом начертите легкую поперечную линию (метку) и по обе стороны от нее на расстоянии ~7 см поставьте знаки «+» и « –».
2. В чашку Петри налейте буферный раствор с рН 9,24 и смочите им полоску бумаги так, чтобы концы ее оставались сухими. Избыток буфера удалите с бумаги, слегка просушив ее между листами фильтровальной бумаги.
3. С помощью пипетки на метку нанесите 0,05 мл (1 капля) смеси аминокислот в виде тонкой полоски.
4. Поместите полоску бумаги в прибор для электрофореза на подставку, чтобы знаки заряда на приборе совпали со знаками на бумаге. Проверьте, чтобы сухие концы полоски бумаги полностью смочились раствором буфера. Закройте прибор крышкой и далее работайте строго по инструкции к данному прибору, проявляя осторожность, так как он работает при высоком напряжении.
5.По окончании электрофореза (~ 25 мин) выключите прибор, достаньте бумагу и, срезав смоченные концы, поместите ее на подставку в сушильный шкаф на 5–7 минут при 800С.
6.Высушенную бумагу смочите налитым в чашку Петри красящим раствором и, не промокая, снова сушите 5–10 минут до появления окрашенных полос: фиолетовой (аспарагин) и розовой (аргинин).
7.Полученную электрофореграмму подклейте в тетрадь, указав название каждой аминокислоты.
На основании полученной электрофореграммы сделайте вывод о знаках заряда аргинина и аспарагина в данной среде, а также укажите, у какой аминокислоты бόльшая скорость электрофореза и почему.
Работа 4.Определение знака заряда частиц золя и величины дзета-потенциала методом электрофореза
Цель работы:научиться определять знак заряда частиц золя и измерять величину x-потенциала методом электрофореза коллоидных растворов.
Реактивы и приборы: прибор для электрофореза коллоидных растворов; 0,01М раствор KI, 0,01М раствор AgNO3, линейка, колба.
Порядок выполнения работы
Для получения коллоидного раствора AgI в конической колбе смешайте 20 мл 0,01М раствора KI и 14 мл 0,01М раствора AgNO3. Электрофорез проводится в стеклянном приборе, который представляет собой сообщающийся сосуд, состоящий из U–образной трубки и соединенной с ней воронки Б с краном 1. При открытом кране заполните сосуд водой до уровня крана. Перекройте кран и налейте по стенке приготовленный золь в воронку так, чтобы в трубку не попали пузырьки воздуха. Осторожно приоткройте кран, чтобы золь медленно заполнил оба колена прибора на 1/3 его объема, закройте кран. Вода при этом займет верхнюю часть U-образной трубки.
 Следите, чтобы граница между золем и водой была четкой. Это достигается при очень медленном вливании золя через кран. Границу золя (2) отметьте карандашом по стеклу в обоих коленах и вставьте в них электроды так, чтобы их концы оказались в водном слое на 3–4 см выше границы раздела. Электроды присоедините к клеммам источника постоянного тока, согласно инструкции к прибору. Когда граница сместиться на 1–1,5 см относительно первоначального положения, прибор выключите, и отметьте время электрофореза в секундах.
Следите, чтобы граница между золем и водой была четкой. Это достигается при очень медленном вливании золя через кран. Границу золя (2) отметьте карандашом по стеклу в обоих коленах и вставьте в них электроды так, чтобы их концы оказались в водном слое на 3–4 см выше границы раздела. Электроды присоедините к клеммам источника постоянного тока, согласно инструкции к прибору. Когда граница сместиться на 1–1,5 см относительно первоначального положения, прибор выключите, и отметьте время электрофореза в секундах.
Запишите направление смещения границы золя и по нему определите заряд частиц золя.
Гибкой проволокой отметьте расстояние между помещенными в раствор концами электродов по линии 3, а по вольтметру определите напряжение на клеммах. Полученные данные оформите в виде следующей таблицы и рассчитайте электрофоретическую подвижность:
смещение границы золя S, м: S =
время электрофореза t, с: t =
расстояние между электродами L, м: L =
напряжение на клеммах Е, В: E =
линейная скорость перемещения границы золя V, м/с: V = S/t =
напряженность электрического поля Н, В/м: Н = E/L =
электрофоретическая подвижность u, м2/с×В: u = V/H =
Затем рассчитайте электрокинетический потенциал x, В:
x = 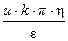 ×Б =
×Б =
где k = 6; h (воды) = 1×10–3 Н×с/м2; e (воды) = 81 при 200С; Б = 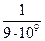 ,
,
Б – коэффициент для перевода электростатических единиц в единицы CИ.
ТЕСТОВЫЙ САМОКОНТРОЛЬ
1.Укажите верные утверждения:
а) при растворении хлорида натрия в воде можно получить коллоидный
раствор;
б) коллоидный раствор – термодинамически неустойчивая система;
в) дисперсная система – это гетерогенная система, состоящая из
дисперсной фазы и дисперсионной среды;
г) размеры частиц дисперсной фазы золя (коллоидного раствора)
более 100 нм.
2.Укажите свойства, характеризующие коллоидные растворы:
а) низкое осмотическое давление;
б) светорассеяние;
в) для частиц дисперсной фазы характерна седиментация;
г) диффузия частиц дисперсной фазы.
3.Укажите факторы, которые уменьшают скорость диффузии:
а) повышение температуры; б) понижение температуры;
в) увеличение размеров частиц; г) уменьшение вязкости раствора.
4.Укажите, в какой из ниже указанных систем при одинаковой массовой концентрации вещества осмотическое давление ниже:
а) раствор хлорида натрия ; б) раствор глюкозы;
в) золь гидроксида железа (III) ; г) раствор хлорида алюминия.
5.Укажите факторы, от которых зависит скорость седиментации:
а) размер частиц дисперсной фазы; б) вязкость дисперсионной среды;
в) плотность дисперсионной среды; г) плотность дисперсной фазы.
6.Коллоидным растворам наиболее характерно оптическое свойство:
а) отражение; б) поглощение; в) дифракция; г) рассеивание.
7.Основу (агрегат) коллоидной частицы (мицеллы) составляют микрокристаллы:
а) труднорастворимого электролита;
б) хорошорастворимого электролита;
а на поверхности агрегата адсорбируются ионы электролита взятого:
в) в избытке; г) в недостатке.
8.Золь карбоната кальция получен путем смешивания равных объемов растворов нитрата кальция и карбоната калия. Укажите, какой заряд имеют гранулы золя, если концентрация Са(NO3)2 выше концентрации К2СО3:
а) положительный; б) отрицательный; в) нейтральный.
9.Золь карбоната бария получен взаимодействием избытка раствора хлорида бария с раствором карбоната аммония. Для мицеллы полученного золя:
А.агрегат состоит из микрокристаллов:
а) BaCl2; б) (NH4)2CO3; в) NH4Cl; г) BaCO3.
Б.потенциалопределяющими ионами являются:
а) 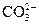 ; б) Cl–; в) Ba2+; г)
; б) Cl–; в) Ba2+; г) 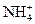 .
.
В.схема ядра имеет вид:
а) [mBaCO3]×n 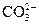 ; б) [mBaCO3] ×2nCl–;
; б) [mBaCO3] ×2nCl–;
в) [mBaCO3] ×2n 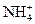 ; г) [mBaCO3] ×nBa2+.
; г) [mBaCO3] ×nBa2+.
Г.противоионами являются ионы:
а) Ba2+ ; б) Cl– ; в) 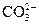 ; г)
; г) 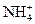 .
.
Д.схема адсорбционного слоя:
а) nBa2+; б) 2nCl–; в) nBa2+×(2n-x)Cl–;
г) 2nCl–×(n-x)Ba2+; д) n 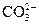 ×(2n-x)
×(2n-x) 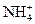 ; е) n
; е) n 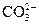 .
.
Е.схема гранулы имеет вид:
а) {[mBaCO3] ×nBa2+×(2n-x)Cl–}x+ ;
б) {[mBaCO3] ×2nCl–×(n-x)Ba2+}2x–;
в) {[mBaCO3] ×nBa2+×(2n-x)Cl–}x–;
г) {[mBaCO3] ×n 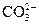 ×(2n-x)
×(2n-x) 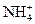 }x–.
}x–.
Ж.заряд гранулы:
а) положительный; б) отрицательный; в) нейтральный
З.диффузный слой состоит из ионов:
а) Ba2+ ; б) 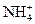 ; в) Cl–; г)
; в) Cl–; г) 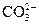 .
.
И.схема мицеллы:
а) {[mBaCO3] ×2nCl–×(n-x)Ba2+}2x– × xBa2+;
б) {[mBaCO3] ×n 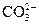 ×(2n-x)
×(2n-x) 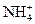 }x–×x
}x–×x 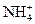 ;
;
в) {[mBaCO3] ×nBa2+×(2n-x)Cl–}x– × xCl–;
г) {[mBaCO3] ×nBa2+×(2n-x)Cl–}x+× xCl–.
10.При смешивании равных объемов растворов нитрата серебра и хлорида натрия образовался золь хлорида серебра, гранулы которого заряжены положительно. Концентрация исходных электролитов:
а) больше в растворе AgNO3; б) больше в растворе NaCl;
в) меньше в растворе NaCl; г) одинаковая.
11.Для получения устойчивых коллоидных растворов (золей) необходимы следующие условия:
а) размеры частиц дисперсной фазы 1–100 нм;
б) хорошая растворимость дисперсной фазы в дисперсионной среде;
в) плохая растворимость дисперсной фазы в дисперсионной среде;
г) наличие стабилизатора (небольшой избыток электролита)
12.Укажите дисперсионные методы получения коллоидных растворов:
а) метод замены растворителя; б) пептизация;
в) химическое окисление; г) механическое дробление.
13.Укажите, какой ион выступает в качестве пептизатора при добавлении к свежеосажденному осадку гидроксида алюминия небольшого количества азотной кислоты:
а) AlО+; б) OH–; в) H+; г) 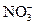 .
.
14.На каких из ниже указанных свойствах основаны методы очистки коллоидных растворов:
а) размеры частиц дисперсной фазы больше размеров частиц примесей;
б) концентрация частиц дисперсной фазы больше концентрации частиц
примесей;
в) диффузия частиц дисперсной фазы через мембрану;
г) диффузия частиц примесей через мембрану.
15.Величина электротермодинамического потенциала частиц золя определяется:
а) количеством потенциалопределяющих ионов в адсорбционном слое;
б) количеством противоионов только в диффузном слое;
в) количеством противоионов только в адсорбционном слое;
г) общим количеством противоионов в адсорбционном и диффузном
слоях.
16.Электрокинетический потенциал частиц коллоидного раствора возникает:
а) между потенциалопределяющими ионами адсорбционного слоя и
всеми противоионами;
б) между ионами адсорбционного слоя и противоионами диффузного
слоя;
в) между агрегатом и потенциалопределяющими ионами адсорбционного
слоя;
г) между гранулой и диффузным слоем.
17.Укажите верные утверждения:
а) величина заряда гранулы может меняться, так как противоионы
диффузного слоя могут переходить в адсорбционный слой и наоборот;
б) чем больше противоионов в диффузном слое, тем больше величина
заряда гранулы;
в) электроосмос – это движение молекул дисперсионной среды
относительно дисперсной фазы в электрическом поле;
г) потенциал протекания возникает при проталкивании под давлением
золя через капилляр.
18.Скорость электрофореза частиц коллоидного раствора увеличивается:
а) с увеличением величины дзета-потенциала;
б) с уменьшением величины дзета-потенциала;
в) с уменьшением вязкости дисперсионной среды;
г) с увеличением напряженности электрического поля.
19.При сливании равных объемов 0,008 М раствора AgNO3 и 0,0096 М раствора NaCl образовался золь хлорида серебра, схема строения мицеллы которого имеет вид:
a){[mAgCl]×nCl–×(n-x)×Na+}x–×xNa+;
б){[mAgCl]×nNa+×(n-x)×Cl–}x+×xCl–;
в){[mAgCl]×nAg+×(n-x)× 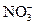 }x+×x
}x+×x 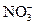 ;
;
а при электрофорезе гранулы вышеуказанного золя:
г) перемещаются к катоду ;
д) перемещаются к аноду;
е) остаются неподвижными.
20.Укажите верные утверждения:
а) в водных растворах аминокислоты находятся в виде биполярных ионов;
б) суммарный заряд аминокислоты в растворе зависит от соотношения
числа амино- и карбоксильных групп в молекуле и от рН среды;
в) разделение аминокислот, белков методом электрофореза основано
на их способности принимать определенный знак заряда в зависимости от рН среды;
г) в электрическом поле при рН среды равном ИЭТ белок перемещается
к катоду.
21.В щелочной среде аминокислота участвует в превращении:
а) 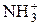 – R – COO– + ОН–
– R – COO– + ОН– 
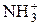 – R – COOН;
– R – COOН;
б) 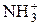 – R – COO– + ОН–
– R – COO– + ОН–  NH2 – R – COO– + Н2О;
NH2 – R – COO– + Н2О;
в) 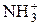 – R – COO– + ОН–
– R – COO– + ОН–  NH2– R – COOH;
NH2– R – COOH;
и при этом суммарный заряд вышеуказанной аминокислоты:
г) отрицательный; д) положительный; е) нейтральный.
22.Для диаминомонокарбоновой аминокислоты значение ИЭТ соответствует:
а) слабокислой среде; б) нейтральной среде; в) слабощелочной среде.
23.При разделении белков (a-глобулин с ИЭТ=4,8, альбумин с ИЭТ=4,64, g- глобулин с ИЭТ=6,4) методом электрофореза использовали буферный раствор с рН=4,9. Укажите белки, которые двигались к аноду:
а) a-глобулин; б) альбумин; в) g- глобулин;
укажите, у какого из вышеуказанных белков в этой среде скорость электрофореза будет больше:
г) a-глобулин; д) альбумин; е) g- глобулин.
24.Желатин с ИЭТ равной 4,7 помещен в раствор, в котором концентрация Н+-ионов в 100 раз больше, чем в воде. При электрофорезе в этом растворе молекулы желатина будут перемещаться:
а) к катоду; б) к аноду ; в) не будут перемещаться.
25.Кинетическая устойчивость коллоидных растворов уменьшается:
а) с уменьшением температуры;
б) увеличением вязкости дисперсионной среды;
в) увеличением температуры;
г) с уменьшением степени дисперсности частиц дисперсной фазы.
26.Укажите факторы агрегативной устойчивости дисперсных систем:
а) наличие ионной оболочки частиц;
б) наличие диффузного слоя;
в) наличие сольватной (гидратной) оболочки частиц;
г) степень дисперсности частиц дисперсной фазы.
27.Механизм коагуляции коллоидных растворов электролитами связан:
а) со сжатием ионной оболочки частиц дисперсной фазы;
б) с увеличением толщины диффузного слоя частиц;
в) уменьшением величины дзета-потенциала частиц;
г) увеличением величины заряда частиц.
28.Укажите, какие участки кривой кинетики коагуляции коллоидного раствора электролитом соответствуют явной коагуляции:
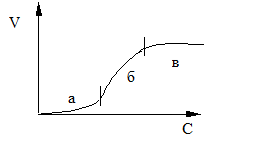
29.Укажите, какой электролит следует взять в избытке при сливании растворов Ba(NO3)2 и Na2SO4, чтобы получить золь сульфата бария с положительнозаряженными гранулами:
а) Ba(NO3)2 ; б) Na2SO4;
коагуляцию вышеуказанного золя можно вызвать ионами:
в) Cl– ; г) Al3+.
30.Чтобы вызвать коагуляцию, к 5 мл золя гидроксида железа (III) потребовалось добавить 1 мл 0,005М раствора сульфата калия. Порог коагуляции данного электролита по отношению к золю Fe(OH)3 равен:
а) 0,001 ммоль/л ; б) 0,001 моль/л; в) 1,0 моль/л; г) 1,0 ммоль/л.
31.Укажите, какой из электролитов будет иметь наименьший порог коагуляции по отношению к золю Fe(OH)3 с положительнозаряженными гранулами:
а) KNO3; б) MgSO4 ; в) AlCl3; г) K3PO4.
32.Укажите, какой знак заряда имеют гранулы золя, полученного путем смешивания растворов CuSO4 и (NH4)2S, если пороги коагуляции этого золя электролитами KCl, MgCl2, AlCl3, соответственно, равны: 50;0,72;0,093 ммоль/л:
а) положительный; б) отрицательный.
33.Рассчитайте защитное действие желатина по отношению к золю гидроксида алюминия (gж/g), если на титрование 10 мл золя без желатина до появления мути ушло 2,3 мл 0,01М раствора K2SO4, а с желатином – 5,0 мл этого же раствора:
а) 0,005; б) 0,0023; в) 2,17; г) 0,46.
34.Повысить устойчивость гидрозоля можно добавлением к нему:
а) глюкозы; б) белка; в) декстрина; г) нитрата кальция.
ЗАДАЧИ
1.При взаимодействии растворов AICI3 и NaОН получен золь Al(OH)3 с положительно заряженными гранулами. Определите, какой электролит взят в избытке при его получении и запишите схему строения мицеллы золя.
2.Свежеосажденный осадок гидроксида железа (III) обработали небольшим количеством соляной кислоты, недостаточным для полного растворения осадка. При этом образовался золь Fe(ОН)3. Напишите формулу мицеллы золя гидроксида железа, учитывая, что в электрическом поле частицы золя перемещаются к катоду. Каким методом получен данный золь ?
3.Золь сульфида железа получен смешиванием равных объемов растворов (NH4)2S и FeCl2. В электрическом поле гранулы перемещались к катоду. Одинакова ли концентрация исходных растворов электролитов? Напишите схему строения мицеллы и назовите ее составные части.
4.Альбумин яйца, изоэлектрическая точка которого 4,8, помещен в раствор, в котором концентрация ОН––ионов в 100 раз меньше, чем в воде. Как заряжен альбумин в растворе ? К какому электроду – катоду или аноду – будет двигаться белок в электрическом поле ?
5.Изоэлектрические точки a-, b- и g-глобулинов крови равны соответственно 4,8; 5,2 и 6,4. Какой заряд имеют эти белки в крови здорового человека ? У какого из глобулинов величина заряда больше ? Ответ поясните.
6.В растворе содержится два белка, изоэлектрические точки которых 4,7 и 8,8. К какому электроду будут перемещаться они при электрофорезе в буферном растворе с рН=7,9. Какой из указанных белков в этой среде (при прочих равных условиях) будет перемещаться быстрее к соответствующему электроду и почему?
7.При взаимодействии растворов AgNO3 и K2CrO4 получен золь Ag2CrO4 с отрицательно заряженными гранулами. Определите, какой электролит взят в избытке при его получении и запишите схему строения мицеллы этого золя. Расположите в ряд по увеличению пороги коагуляции электролитов MgSO4, Al(NO3)3 и K4[Fe(CN)6] по отношению к этому золю.
8.Пороги коагуляции для электролитов KCl, MgCl2, AlCl3 по отношению к некоторому золю соответственно равны 50, 0,72; 0,093 ммоль/л. Какие ионы указанных солей – катионы или анионы – вызывают коагуляцию данного золя ? Какой знак заряда имеют гранулы золя ?
9.В три колбы налито по 100 мл золя Fe(ОН)3. Чтобы вызвать явную коагуляцию золя, потребовалось добавить в первую колбу 10,5мл 1М раствора KCl, во вторую – 62,5мл 0,01М раствора Na2SO4, в третью – 37,0мл 0,001М Na3PO4. Вычислите пороги коагуляции для данных электролитов по отношению к золю гидроксида железа (III) и определите знак заряда частиц золя.
10.Вычислите скорость и электрофоретическую подвижность частиц коллоидной платины, если дзета-потенциал частиц равен 60 мВ, разность потенциалов между электродами 240В, расстояние между электродами 20 см, вязкость 1×103 Н×с/м2, диэлектрическая постоянная 81. Форма частиц золя цилиндрическая.
Дата добавления: 2020-07-18; просмотров: 1135;










