Классификация эмульгаторов
| Тип эмульгатора | Гидрофильные эмульгаторы для эмульсий типа м/в | Гидрофобные эмульгаторы для эмульсий типа в/м |
| Порошки | СаСО3, CaSO4, Fe2O3, Fe(OH)3, SiO2, глина и др. | HgI2, PbO, сажа, графит и др. |
| Высокомолекулярные ПАВ | Желатин, казеин, альбумин, декстрины, лецитин, холевые кислоты желчи и др. | Смолы, каучук, холестерин и др. |
| Низкомолекулярные ПАВ | Мыла щелочных металлов: R – COOMe | Мыла щелочноземельных металлов: (R–COO)2Me |
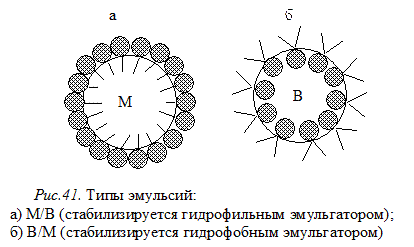
Механизм стабилизирующего действия эмульгаторов различен, но есть общие закономерности, которые характеризуются правилом Банкфорта: гидрофильные эмульгаторы (ПАВ, лучше растворимые в воде, чем в «масле» или порошки, смачивающиеся водой) стабилизируют прямые эмульсии (М/В), а гидрофобные эмульгаторы (ПАВ, лучше растворимые в неполярной жидкости, или порошки, смачивающиеся этой жидкостью) способствуют образованию обратных эмульсий (В/М). Другими словами, дисперсионной средой эмульсии будет жидкость, с которой у эмульгатора большее сродство.
По одной из современных теорий, молекулы ПАВ, взаимодействуя полярными группами с водой, а углеводородными цепями – с «маслом», образуют по обе стороны от поверхности раздела фаз соответственно гидратный и сольватный слои. Образовавшаяся сольватная или гидратная оболочка не дает капле слиться с другими каплями эмульсии. Соотношение между размерами толщины этих слоев определяет тип эмульгатора, а, следовательно, и тип эмульсии. Если гидратная оболочка толще сольватной оболочки (т.е. преобладают гидрофильные свойства), то эмульгатор имеет сродство с водной дисперсионной средой и стабилизирует прямую эмульсию. Если толще сольватная оболочка, то стабилизируется обратная эмульсия, поскольку у эмульгатора большее сродство с неполярной дисперсионной средой.
Низкомолекулярные ПАВ с длиной цепи от 12 до 18 атомов углерода проявляют наиболее выраженное эмульгирующее действие. Например, мыла щелочных металлов (R–СООNa) стабилизируют прямые эмульсии (рис.41а) и не могут образовывать устойчивые обратные эмульсии, а мыла щелочноземельных металлов ((R–СОО)2Сa) формируют устойчивые обратные эмульсии (41б) и не стабилизируют прямые эмульсии.
Механизм стабилизации высокомолекулярными ПАВ аналогичен. Но они являются менее устойчивыми эмульгаторами, чем низкомолекулярные ПАВ.
В зависимости от типа полярной группы (ионогенные или неионогенные) капли эмульсии могут приобретать еще и заряд, что дополнительно стабилизирует ее.
Эмульгирующая способность порошков значительно меньше, чем у ПАВ. Механизм стабилизации эмульсии порошками заключается в образовании на поверхности капли структурно-механического барьера из частиц высокодисперсного порошка, который ограждает капли от сливания. Образуя вокруг капли сплошной слой, частицы порошка располагаются так, чтобы бόльшая часть их находилась в дисперсионной среде. Следовательно, частицы порошка должны лучше смачиваться дисперсионной средой, чем дисперсной фазой, но не намного. Иначе сплошная пленка порошка не образуется. Примерами гидрофильных порошков, стабилизирующих прямые эмульсии, являются мел (СаСО3), глина, гипс, некоторые металлы, хорошо смачивающиеся водой. А гидрофобные сажа, графит и многие металлы, лучше смачивающиеся малополярной жидкостью, стабилизируют обратные эмульсии.
Разрушение эмульсии можно вызвать повышением температуры, центрифугированием, фильтрованием через пористый материал и другими физическими методами. Разрушить эмульсию можно и химическим способом, например, добавлением к ней электролита или ПАВ. При этом ПАВ должно быть более поверхностноактивно, чем эмульгатор, и не должно образовывать структурные слои, т.е. сольватные оболочки.
Методы определения типа эмульсий. Тип эмульсий устанавливают на основании различий физико-химических свойств полярной и неполярной жидкостей. Например, кондуктометрический метод основывается на различной электропроводимости полярной и неполярной жидкостей. Более высокие значения электрической проводимости свидетельствуют о том, что непрерывной жидкостью, т.е. дисперсионной средой, является вода, а тип эмульсии – М/В и, наоборот, для эмульсии типа В/М характерны низкие значения электропроводности, так как дисперсионной средой в этом случае является малополярная органическая жидкость. Данный метод чаще применяется для эмульсий, взятых в малом количестве.
Тип эмульсий можно определить по различной смачиваемости твердой поверхности жидкостью. Эмульсия типа М/В хорошо смачивает гидрофильную (полярную) поверхность, а типа В/М – гидрофобную. Примером может служить смачивание фильтровальной бумаги: если нанесенная на нее капля эмульсии быстро распространяется по ее поверхности, оставляя небольшую каплю в центре, то дисперсионной средой является вода, а тип эмульсии – М/В. Если эмульсия бумагой не впитывается, то эмульсия – В/М.
В основе метода разбавления (смешивания) лежит способность эмульсии легко разбавляться, т.е. смешиваться с жидкостью, которая является ее дисперсионной средой. Обычно определение проводят с двумя каплями эмульсии, сравнивая их способность слиться с каплей воды и каплей «масла». Если капля эмульсии сливается с каплей воды, но не сливается с каплей «масла», то тип эмульсии будет М/В, и наоборот – В/М, если капля эмульсии сливается с каплей «масла». Недостаток метода: возможность перехода дисперсной фазы в дисперсионную среду (см. ниже «обращение фаз эмульсий»).
Метод окрашивания основан на различной растворимости красителей в жидкостях. Водорастворимые (гидрофильные) красители, например, метиленовый синий, окрашивают воду, а маслорастворимые (гидрофобные) красители окрашивают «масло», например краситель красного цвета судан (III). Эти два красителя аккуратно перемешивают с эмульсией, и каплю полученной смеси помещают под микроскоп. Если капли дисперсной фазы будут окрашены в красный цвет, а фон (дисперсионная среда) – в синий, то это эмульсия I рода (М/В). И если фон окрашен в красный цвет, а капли – в синий, то это эмульсия II рода (В/М),
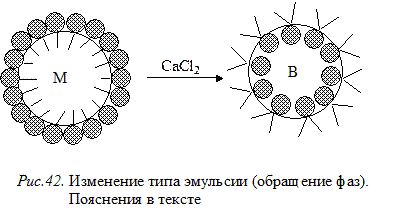
Обращение фаз эмульсии–это переход эмульсий прямого типа в эмульсию обратного типа и наоборот. Данное свойство характерно только эмульсиям. Практически это явление можно вызвать разными способами: изменением температуры или концентрации эмульсии, добавлением эмульгатора другого типа и т.д. Но наиболее эффективен метод изменения природы эмульгатора путем химического воздействия на него. Например, если при получении эмульсии из воды и жира добавить раствор соли щелочного металла, то образуется эмульгатор, стабилизирующий прямую эмульсию (М/В):
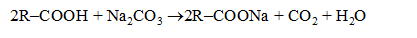
При добавлении в полученную эмульсию раствора соли щелочноземельного металла, гидрофильный эмульгатор превращается в гидрофобный:
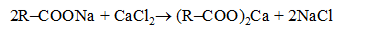
При этом прямая эмульсия переходит в обратную эмульсию (рис.42).
Значение эмульсий. Примерами природных эмульсий являются нефть, млечный сок каучуконосных растений, лимфа, также яичный желток, молоко и продукты его переработки (майонез, сметана, сливки, сливочное масло, маргарин). К эмульсиям относятся и продукты производства, например, лакокрасочные эмульсии, распыляемые смеси для борьбы с вредителями в сельском хозяйстве, кремы и мази в парфюмерии, лекарственные препараты.
Эмульсии имеют большое значение в жизни человека. Жиры, к примеру, являются необходимой составной частью питания, но они нерастворимы в водной среде, составляющей основу жизнедеятельности организма. Поэтому организм хорошо усваивает эмульгированные жиры, например, молоко, сливки, сметану и т.д. Другие потребляемые с пищей жиры (растительное масло, животный жир) усваиваются только после перевода их в эмульгированное состояние, вначале в желудке, а затем – в двенадцатиперстной кишке. В желудок также поступает желчь, которая содержит холевые кислоты, являющиеся хорошими эмульгаторами (ПАВ). Под действием этих кислот жиры самопроизвольно эмульгируют, причем перистальтические движения кишечника оказывают диспергирующее действие. Получающаяся в результате прямая высокодисперсная эмульсия легко всасывается через стенки тонких кишок и поступает в лимфу и кровь.
Многие лекарства для лучшей их усвояемости готовят в виде эмульсий. При этом внутрь, как правило, применяют прямые эмульсии (М/В), поскольку во всех биологических жидкостях дисперсионной средой является вода. А для наружного применения (втирания, мази) используют обратные эмульсии (В/M), так как кожа гидрофобна и непроницаема для воды и растворимых в ней препаратов.
Аэрозоли
Аэрозолями называются дисперсные системы с газообразной дисперсионной средой. По агрегатному состоянию фаз и размерам частиц их классифицируют на туманы (ж/г) – размеры капель дисперсной фазы 10–7 – 10–5 м; дымы (тв/г) – размеры частиц 10–9 –10–5 м; пыли (тв/г) – размеры частиц свыше 10–5 м. Дымы являются наиболее высокодисперсными системами и обычно получаются методом конденсации, а пыли – методом диспергирования.
При определенных условиях образуются системы смешанного типа, когда на твердых частицах фазы конденсируется влага. Так возникает «смог» – туман, образующийся на частицах дыма.
Различают аэрозоли, образующиеся естественным путем вследствие различных природных явлений (облака, туман) и искусственным путем в результате производственной деятельности человека (добыча и переработка руд, угля, измельчение материалов, производство цемента, сжигание топлива и т.д.). Последние в большинстве случаев крайне нежелательны.
Методы получения аэрозолей – конденсация и диспергирование. Чаще используют методы диспергирования: распыление раствора сжатым воздухом с помощью различных пульверизаторов; разбрызгивание жидкостей ультрацентрифугой; разбрызгивание в электрическом поле (промышленное получение лекарственных аэрозолей). Для получения аэрозолей с высокой концентрацией, например, аэрозолей водных растворов антибиотиков, используют разбрызгивание с помощью ультразвука.
Характерной особенностью аэрозолей является незначительная вязкость дисперсионной среды (газа), что обуславливает очень низкую кинетическую устойчивость аэрозолей, приводящую к быстрому осаждению частиц дисперсной фазы. Для них также характерна и агрегативная неустойчивость. Поэтому возможность длительного существования аэрозолей связана с высокой дисперсностью и малой концентрацией частиц дисперсной фазы (факторы кинетической устойчивости), а так же с их ионизацией (факторы агрегативной устойчивости).
Электрические свойства аэрозолей сильно отличаются от электрических свойств лиозолей (систем с жидкой дисперсионной средой), что объясняется большой разницей между плотностями газов и жидкостей, а также разницей в их диэлектрических свойствах. В отличие от жидкостей, в газовой среде отсутствует электролитическая диссоциация и, как следствие этого, возможность образования ДЭС. Поэтому частицы аэрозолей могут приобрести заряд только при столкновении друг с другом или с какой-либо поверхностью, а также при адсорбции ионов, образующихся при ионизации газов под действием ультрафиолетового или радиоактивного излучения из космоса.
В промышленности для получения заряженных аэрозолей концентрации атмосферных ионов недостаточно. Поэтому воздух ионизируют, например, с помощью электрического разряда.
Аэрозоли, как естественные, так и промышленные, наносят большой вред, поэтому крайне актуальны способы коагуляции аэрозолей. К нарушению их устойчивости приводят увеличение концентрации частиц (капель) дисперсной фазы, повышенная влажность среды. На коагуляцию аэрозолей, особенно на туманы, сильно влияет изменение температуры.
Ионизация аэрозолей в процессе их получения, с одной стороны, придает им устойчивость, а с другой – способствует очищению газов от частиц дисперсной фазы. Этот принцип лежит в основе промышленных установок по очистке дымов и пылей. Вначале ионизируют воздух, при этом частицы дисперсной фазы заряжаются, а затем их осаждают на поверхности металлических труб, через которые пропускают аэрозоль. Такие установки называются электрофильтрами.
Роль аэрозолей в природе, в быту и промышленности чрезвычайно велика. Например, влияние облаков и туманов на климат, перенос ветром семян и пыльцы растений, пневматические способы окраски, применение распыленного топлива, борьба с вредителями, внесение удобрений и т.д.
В то же время аэрозоли, образовавшиеся в результате жизнедеятельности человека (пыли, дымы), а также природые арозоли (туманы, смог) крайне нежелательны и наносят вред живым организмам. Улавливание пылей и борьба с дымами при современном развитии производства стала важнейшей проблемой в охране окружающей среды. Для ее решения используется фильтрация газов, осаждение частиц в установках типа циклон, осаждение аэрозолей, подвергнутых ионизации, в электрофильтрах и т.д.
Аэрозоли широко применяются в медицине. Одним из наиболее эффективных способов лечения органов дыхания оказались ингаляции различных лекарственных препаратов в виде аэрозолей. Ими лечат простуды, инфекционные и аллергические заболевания легких, бронхов, горла, носа. Стерильные аэрозоли в специальных упаковках применяются для стерилизации операционного поля, ран, ожогов. Аэрозоли локального применения используются вместо перевязочного материала, аэрозоли в виде клея – в хирургической практике для склеивания ран кожи, бронхов, сосудов и т.д.
Порошки можно рассматривать как осажденные аэрозоли с твердыми частицами и обычно они полидисперсны. В зависимости от размера частиц порошки называют песком (10–2 –10–5 м), пылью (10–5 –10–6 м), пудрой (менее 10–6 м). Размер частиц промышленных порошков зависит от их целевого назначения и часто является одним из основных показателей качества продукции.
Методы получения порошков аналогичны методам получения золей и суспензий. Часто вначале получают суспензию методом химической конденсации, а затем путем фильтрации и сушки – порошки.
Как все системы с газообразной дисперсионной средой, порошки агрегативно и седиментационно неустойчивы и вследствие значительно большей концентрация частиц дисперсной фазы характеризуются рядом специфических свойств – слипаемость, сыпучесть (текучесть), гигроскопичность, влажность и др.
Важным свойством порошков является их способность к гранулированию. Гранулированием называется процесс образования в порошкообразной массе гранул шарообразной или цилиндрической формы, более или менее однородных по величине. Этот процесс может идти самопроизвольно, потому что приводит к уменьшению поверхностной энергии Гиббса.
Гранулирование можно вызвать разными способами, например, добавлением к порошку определенного количества жидкости. При этом его поверхность смачивается, в результате чего склеиваются частицы. Этот процесс требует непрерывного перемешивания. Процесс гранулирования играет большую роль в фармакологии, так как гранулы являются одной из лекарственных форм. Кроме того, гранулы служат промежуточным продуктом, из которого путем прессования получают таблетки. До 80% готовых лекарств составляют порошки, гранулы, таблетки. По составу фармацевтические порошки могут быть одно- и многокомпонентными.
ОСНОВНЫЕ ВОПРОСЫ ТЕМЫ
1.Классификация и общие свойства грубодисперсных систем.
2.Суспензии, их получение и свойства. Пасты.
3.Эмульсии, их классификация, свойства и методы получения.
4.Эмульгаторы, их природа и механизм действия.
5.Методы определения типа эмульсии.
6.Биологическая значимость эмульсий.
7.Аэрозоли, их получение и свойства. Порошки.
Дата добавления: 2020-07-18; просмотров: 1327;










