Молекулярно-кинетические свойства коллоидных растворов
К молекулярно-кинетическим свойствам свободнодисперсных систем относятся: броуновское движение, диффузия, осмотическое давление, седиментация.
Броуновское движение проявляется хаотическим непрерывным движением частиц дисперсной фазы под действием ударов молекул растворителя (дисперсионной среды), находящихся в состоянии интенсивного молекулярно-теплового движения. Перемещаться частицы могут в различных направлениях. Траектория их движения представляет собой ломаную линию неопределенной конфигурации (рис.31).
 Количественной мерой перемещения частицы при броуновском движении является величина её среднего смещения за некоторый промежуток времени. Смещением или сдвигом частицы называют расстояние между проекциями начальной (1) и конечной (2) точек траектории на ось смещений.
Количественной мерой перемещения частицы при броуновском движении является величина её среднего смещения за некоторый промежуток времени. Смещением или сдвигом частицы называют расстояние между проекциями начальной (1) и конечной (2) точек траектории на ось смещений.
А.Эйнштейн и М.Смолуховский установили, что квадрат среднего смещения равен:
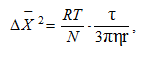
где ΔX – среднее смещение частицы, м–1; R – газовая постоянная, равная 8,31 Дж×моль/К; Т – температура, К; N – число Авогадро, моль–1; τ – время смещения, с; η – вязкость дисперсионной среды, Н×c/м2; r – радиус дисперсной частицы, м.
Из этого уравнения следует, что броуновское движение тем интенсивнее, чем меньше размер частиц и вязкость среды и чем выше температура. Броуновское движение не прекращается со временем, т.е. не зависит от длительности существования системы.
Диффузия – это самопроизвольно протекающий процесс выравнивания концентраций ионов, молекул или коллоидных частиц вследствие их беспорядочного теплового (для истинных растворов) или броуновского (для дисперсных систем) движения. Диффузия заканчивается с достижением равномерного распределения частиц по всему объему. Следовательно, диффузия возможна лишь в системах с неодинаковыми концентрациями.
Величина, показывающая количество вещества, диффундирующего через поперечное сечение площадью 1 м2 за 1 секунду при градиенте концентраций равном 1, называется коэффициентом диффузии.
По формуле Стокса–Эйнштейна коэффициент диффузии связан с размерами диффундирующих частиц уравнением:
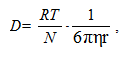
где D – коэффициент диффузии, м2/с.
Из этого уравнения следует, что чем больше размер частиц и выше вязкость среды, тем меньше скорость диффузии. Следовательно, при одинаковой температуре скорость диффузии в коллоидных растворах в сотни и тысячи раз меньше, чем в истинных растворах.
Осмотическое давление –одно из коллигативных свойств растворов, т.е. зависит только от количества свободно движущихся частиц. Следовательно, оно характерно, как для коллоидных растворов, так и для истинных, и для расчета величины осмотического давления коллоидных растворов также можно применить уравнение Вант-Гоффа:
Росм. = 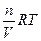 ,
,
где Росм. – осмотическое давление золя, Па; n – количество частиц, моль; V– объем золя, м3; R– газовая постоянная; Т– температура, К.
Если учесть, что объем и масса коллоидной частицы значительно больше, чем объем и масса молекулы низкомолекулярных веществ, то при одной и той же массовой концентрации вещества, в единице объема золя содержится значительно меньше частиц, чем в единице объема истинного раствора. Поэтому осмотическое давление коллоидных растворов ничтожно мало по сравнению с таковым в истинных растворах. Например, осмотическое давление золя золота с массовой концентрацией вещества 10 г/л равно 45 Па, а раствора сахарозы той же концентрации и в тех же условиях – 72500 Па.
Второй особенностью осмотического давления коллоидных растворов является его непостоянство. В связи с термодинамической неустойчивостью коллоидных растворов в них непрерывно протекают процессы агрегации и дезагрегации, приводящие к изменению числа осмотически активных частиц в единице объема, а, следовательно, и осмотического давления.
Седиментация –этосамопроизвольное оседание частиц под действием силы тяжести. В свободнодисперсных системах частицы вещества, диспергированные в дисперсионной среде, находятся под действием двух противоположно направленных сил: силы тяжести и сил диффузии. В истинных растворах ввиду малой массы их частиц (молекул, ионов, атомов) силы диффузии преобладают над силами тяжести, происходит выравнивание концентраций по всему объему системы. В грубодисперсных системах, где размер частиц довольно велик, сила тяжести значительно больше сил диффузии, что способствует осаждению и концентрированию частиц на дне сосуда. Скорость седиментации рассчитывается по уравнению Стокса:
U = 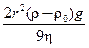 ,
,
где U – скорость седиментации частиц, м/с; r – радиус сферических частиц, м;
r и r0 – соответственно плотности дисперсной фазы и дисперсионной среды,
кг/м 3; η – вязкость среды, Н×с/м2; g – ускорение свободного подения, равное
9,8 м/с2.
Из уравнения следует, что если плотность частиц дисперсной фазы больше плотности дисперсионной среды, т.е. разность (r – r0) > 0, то частицы оседают; если же плотность частиц меньше плотности среды, например, в эмульсии масла в воде, то (r – r0) < 0 (разность с обратным знаком), и вместо осаждения происходит всплытие частиц по тому же закону.
Если при достижении равновесия основная масса частиц дисперсной фазы за сравнительно короткое время окажется в осадке (или всплывет), систему считают кинетически (седиментационно) неустойчивой. Это характерно для грубодисперсных систем (суспензий, эмульсий и т.п.). Если же частицы в основном остаются во взвешенном состоянии, система является кинетически устойчивой. К таким системам относятся коллоидные растворы (золи).
В коллоидных растворах между силами тяжести и силами диффузии устанавливается седиментационное равновесие, при котором концентрация дисперсной фазы закономерно понижается от нижних слоев к верхним и остается постоянной во времени.
Седиментационный анализ применим для качественной оценки функционального состояния эритроцитов. Скорость оседания эритроцитов (СОЭ) значительно изменяется при различных заболеваниях, что используется в диагностике.
Оптические свойства дисперсных систем
Специфика оптических свойств дисперсных систем обусловлена их основными признаками: гетерогенностью и дисперсностью. Дисперсные системы неоднородны по фазовому составу, поэтому для них характерна оптическая неоднородность. Прохождение света через дисперсную систему сопровождается такими явлениями, как его преломление, поглощение, отражение и рассеяние. Преобладание одного из этих явлений зависит главным образом от соотношения между длиной волны падающего света и размером взвешенных частиц.
В грубодисперсных системах размер частиц превышает длину волны видимой части спектра, что способствует отражению света от поверхности частиц. Поэтому данные растворы мутные (непрозрачные).
В истинных растворах размеры частиц растворенного вещества (молекулы, ионы, атомы) значительно меньше длины волны. Такие растворы оптически пусты (прозрачные).
В высокодисперсных системах (коллоидных растворах) размер частиц соизмерим с длиной волны видимого света, в результате чего в таких растворах преобладает светорассеяние. Для коллоидных неокрашенных растворов светорассеяние проявляется в виде опалесценции,т.е. свечения матового цвета, чаще всего голубоватых оттенков.
Теория светорассеяния дисперсными системами была разработана Д. Рэлеем в 1871 г. Она устанавливает зависимость интенсивности рассеянного света от внешних и внутренних факторов и математически эта зависимость выражается в виде формулы Рэлея:
I = 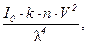
где I – интенсивность рассеянного света в направлении, перпендикулярном к лучу падающего света, Вт/м2; I0– интенсивность падающего света, Вт/м2;
n –число частиц в единице объема золя, м–3; V – объем частиц дисперсной фазы, м3; l– длина волны падающего света, м; k – константа, зависящая от разности показателей преломления дисперсионной среды и дисперсной фазы, м3.
Из уравнения можно сделать вывод, что интенсивность рассеянного света обратно пропорциональна четвертой степени длины волны падающего света. Это означает, что при прохождении пучка белого света рассеиваются преимущественно наиболее короткие волны – синей и фиолетовой части спектра. Действительно, для систем с неокрашенным веществом дисперсной фазы при боковом освещении характерна голубоватая опалесценция. Этим объясняется голубой цвет табачного дыма, керосина, снятого молока. Голубой цвет неба также обусловлен рассеянием света мельчайшими капельками воды и флуктуациями плотности газов атмосферы.
Благодаря светорассеянию коллоидные растворы можно легко отличить от молекулярных и ионных. Дисперсную фазу обнаруживают при помощи эффекта Фарадея – Тиндаля. Яркий свет от сильного источника (дуга или лампа) фокусируют посредством конденсорной линзы на плоскую кювету с раствором. При наблюдении сбоку чистая жидкость или молекулярные растворы (бесцветные и окрашенные) представляются оптически пустыми, тогда как в случае коллоидного раствора наблюдается равномерное свечение освещенного участка (эффект Тиндаля). Наличие отдельных блесток указывает на присутствие грубодисперсных частиц, которым характерно не рассеяние, а отражение света.
Дата добавления: 2020-07-18; просмотров: 390;










